题目内容
【题目】(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
根据表中数据,计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的K。
CO(g)+H2O(g)的K。
①平衡常数的表达式K1=___;
②温度为973K时:K=___;(结果保留小数点后2位)
③反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。
【答案】< ![]() 0.62 吸热 没有 此时Qc=
0.62 吸热 没有 此时Qc=![]() =
=![]() ≈0.0123<0.32=K >
≈0.0123<0.32=K >
【解析】
(1)依据反应自发进行的判断依据△H-T△S<0分析判断;
(2)①Fe(s)+CO2(g)FeO(s)+CO(g) I、Fe(s)+H2O(g)FeO(s)+H2(g) II,
将方程式I-II得CO2(g)+H2(g)CO(g)+H2O(g),则化学平衡常数K=
c(CO).c(H2O) |
c(CO2).c(H2) |
=
K1 |
K2 |
,计算温度为973K时K值;
②根据K=
K1 |
K2 |
③升高温度,平衡向吸热反应方向移动,根据K值判断正反应的反应热.
(3)根据转化率计算各物质的浓度,进而计算Qc,与平衡常数相比较,可判断反应是否达到平衡状态,并判断反应的方向.
(1)2NO+2CO2CO2+N2 反应的△S<0,反应自发进行△H-T△S<0,则反应焓变一定小于0,△H<0,反应是放热反应,故答案为:<;
(3)①Fe(s)+CO2(g)FeO(s)+CO(g)I、Fe(s)+H2O(g)FeO(s)+H2(g)II,
将方程式III得CO2(g)+H2(g)CO(g)+H2O(g),则化学平衡常数K={c(CO)×c(H2O)}÷{c(CO2).c(H2)}={ c(CO)÷c(CO2)}×{c(H2)c(H2O)}=K1÷K2,温度为973K时K=1.47÷2.38=0.62,
故答案为:![]() ;0.62;
;0.62;
③升高温度,化学平衡常数增大,说明平衡向正反应方向移动,则正反应是吸热反应,故答案为:吸热。
(3)某时刻经测定CO的转化率为10%,则
CO(g)+H2O(g)![]() CO2(g)+H2(g),
CO2(g)+H2(g),
起始(mol/L):1 1 0 0
转化(mol/L):0.1 0.1 0.1 0.1
某时刻(mol/L):0.90.9 0.1 0.1
Qc=0.1×0.1÷(0.9×0.9)=0.012<0.32,
则没有达到平衡状态,反应向正反应方向移动,v正>v逆,
故答案为:没有;

 全能练考卷系列答案
全能练考卷系列答案【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
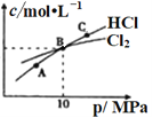
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。