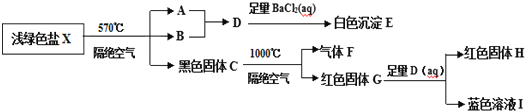
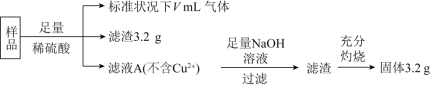题目内容
【题目】为了测定某铜银合金的成分,将![]() 合金完全溶解于
合金完全溶解于![]() 的浓硝酸中,收集到
的浓硝酸中,收集到![]() 标准状况
标准状况![]() 的气体
的气体![]() 反应生成气体只有NO和
反应生成气体只有NO和![]() ,并测得溶液中
,并测得溶液中![]() ,假设反应前后溶液的体积不变,则气体中NO、
,假设反应前后溶液的体积不变,则气体中NO、![]() 的体积比为
的体积比为
A.1:1B.2:1C.3:1D.1:3
【答案】B
【解析】
反应的n(HNO3)=13.5molL1×0.08L1.0molL1×0.08L=1mol,设合金中铜、银物质的量分别为xmol、ymol,则:64x+108y=30①
产物Cu(NO3)2、AgNO3中含![]() 物质的量各为2xmol、ymol,据N守恒可得:2x+y+0.3=1②
物质的量各为2xmol、ymol,据N守恒可得:2x+y+0.3=1②
联立①②,解得x=0.3y=0.10mol,
令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒,则: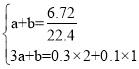 ,解得a=0.2,b=0.1,故NO、
,解得a=0.2,b=0.1,故NO、![]() 的体积比为2:1,
的体积比为2:1,
故答案为:B。

 阅读快车系列答案
阅读快车系列答案【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
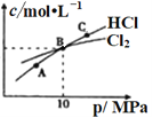
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。