题目内容
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大。A元素的基态阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子核外有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子排布图为_________。
(2)B、C、D三种元素第一电离能由大到小排序为____(填元素符号,下同),它们的电负性由小到大排序为____。
(3)标准状况下,a L C2气体含π键的物质的量为__。与C2D互为等电子体的分子有___(任写一种)。B、C分别与D构成的阴离子中,立体构型为平面三角形的有___(填离子符号)。
(4)由A、B、C、D中的几种原子构成的分子中,含极性键的非极性分子有___(填一种,下同);既含极性键,又含非极性键的极性分子有___。
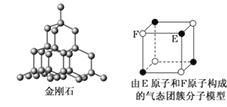
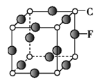
(5)C、F组成的晶体的晶胞如图所示。已知该晶体密度为ρ g·cm-3,NA代表阿伏加德罗常数的值,则C、F最近的核间距为____ pm。
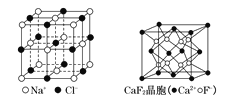
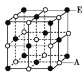
(6)A和E组成晶体,其晶胞如图所示。E粒子周围有___个E紧密相邻且最近;连接与E粒子等距离且最近的A粒子构成的形状是_____。
【答案】![]() N>O>C C<N<O
N>O>C C<N<O ![]() mol CO2、CS2等
mol CO2、CS2等 ![]() 、
、![]() CH4、CO2、C2H4、C2H2等(任写一种) N2H4、H2O2等(任写一种)
CH4、CO2、C2H4、C2H2等(任写一种) N2H4、H2O2等(任写一种) ![]() 12 正八面体形
12 正八面体形
【解析】
基态锂离子的电子排布式为1s2,A元素的基态阴离子的电子排布式与基态锂离子的相同,则A为H;
基态B原子核外有3个能级且各能级上容纳的电子数相等,则B的核外电子排布式为1s22s22p2,则B为C;
基态D原子核外有2个未成对电子,最外能层符号为L,则D原子核外电子排布式为1s22s22p4,有2+2+4=8个电子,则D为O;
B(C)、C、D(O)原子序数依次增大,则C为N;
+1价F离子的3d能级达到全充满结构,则基态F原子的核外电子排布式为[Ar]3d104s1,则F为Cu;
E和A(H)同主族,且原子序数比D(O)大,比F(Cu)小,则E为Na或K;
综上所述,A、B、C、D、E、F分别为:H、C、N、O、Na或K、Cu,据此解答。
(1)C为N元素,基态N原子有5个价电子,其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)B(C)、C(N)、D(O)位于同一周期,一般情况下,同周期元素从左往右,第一电离能增大,C的第一电离能最小,N的核外电子排布式为1s22s22p3,O的核外电子排布式为1s22s22p4,N的2p轨道半充满,比O稳定,第一电离能比O大,即第一电离能:N>O>C。元素的非金属越强,电负性越大,即电负性:C<N<O,故答案为:N>O>C;C<N<O;
(3)C为N,C2即N2,标准下,aLN2的物质的量=![]() ,1个N2中含2个π键,则a L C2气体含π键的物质的量=
,1个N2中含2个π键,则a L C2气体含π键的物质的量=![]() =
=![]() mol。C2D即N2O,原子数和价电子数均相等的微粒互为等电子体,N2O分子中原子数为3,价电子数为16,与其互为等电子体的有CO2、CS2等。B(C)、C(N)分别与D(O)构成的阴离子有CO32-、NO3-、NO2-等,
mol。C2D即N2O,原子数和价电子数均相等的微粒互为等电子体,N2O分子中原子数为3,价电子数为16,与其互为等电子体的有CO2、CS2等。B(C)、C(N)分别与D(O)构成的阴离子有CO32-、NO3-、NO2-等,![]() 、
、![]() 为平面三角形,NO2-为V形,故答案为:
为平面三角形,NO2-为V形,故答案为:![]() mol;CO2、CS2等;
mol;CO2、CS2等;![]() 、
、![]() ;
;
(4)由A(H)、B(C)、C(N)、D(O)中的几种原子构成的分子有H2O、NH3、CH4、CO2、C2H4、C2H2、CO、NO、NO2等,其中,CH4的空间构型为正四面体,CO2为直线形分子,C2H4为平面型分子且键角为120°,C2H2为直线形分子,以上四种分子正负电荷中心重合,均为含有极性键的非极性分子,故答案为:CH4、CO2、C2H4、C2H2等(任写一种);
(5)C为N、F为Cu,根据均摊法可知,黑球所代表的原子个数=![]() =3,白球所代表的原子个数=
=3,白球所代表的原子个数=![]() =1,所以白球代表N,黑球代表Cu,该晶体为Cu3N,则一个晶胞的质量=
=1,所以白球代表N,黑球代表Cu,该晶体为Cu3N,则一个晶胞的质量=![]() g=
g=![]() g,设晶胞参数为apm,则
g,设晶胞参数为apm,则![]() g=(a×10-10cm)3×ρ g·cm-3,则a=
g=(a×10-10cm)3×ρ g·cm-3,则a=![]() ,所以C(N)、F(Cu)最近的核间距=
,所以C(N)、F(Cu)最近的核间距=![]() =
=![]() pm,故答案为:
pm,故答案为:![]() ;
;
(6)A和E组成晶体,其晶胞类似NaCl晶胞,E周围有12个E粒子紧密相邻且最近。E周围等距离且最近的A粒子有6个,连接这6个A,构成正八面体,故答案为:12;正八面体。

【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
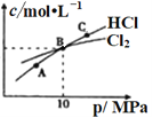
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。