题目内容
16.绿矾(FeSO4•7H2O)是抗贫血药物的主要成分,可用于缺铁性贫血的治疗.某校化学学习小组对绿矾展开了制备、定性和定量探究.请你帮助完成相应实验或问题.查阅资料:绿矾(相对分子质量为278)在300℃失去全部结晶水,FeSO4在600℃以上发生分解.
Ⅰ.制备:
取除去油脂的废铁屑(含少量的铁锈和碳)于一烧杯中,加入20~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤、冷却结晶、再次过滤、冰水洗涤、小心烘干,得到绿矾晶体.加入稀硫酸的实验中可能的反应有3个:Fe+2H+=Fe2++H2↑,Fe2O3+6H+=2Fe3++3H2O和Fe+2Fe3+=3Fe2+(写离子方程式).
Ⅱ.定性探究:
学习小组拟通过实验探究绿矾热分解的产物,提出如下4种猜想:R
甲:FeO、SO2、H2O 乙:Fe2O3、SO3、H2O 丙:Fe2O3、SO2、H2O 丁:Fe2O3、SO2、SO3、H2O
(1)根据氧化还原反应原理,上述猜想乙肯定不成立.
(2)设计实验:针对其它三种猜想,设计如下图所示的实验装置(夹持仪器等均省略):

(3)实验过程:
①连接仪器并检查装置的气密性,放入固体试剂,通N2排空气.
②称取绿矾晶体5.56g置于A中,加热到600℃以上.
③一段时间后,打开K通N2,移开酒精灯,冷却A装置至室温、称量,测得剩余固体的质量为2.32g.
此步通N2的主要目的是将分解产生的气体全部排出(任写一点).
④观察到B装置中无水硫酸铜变蓝,C中锥形瓶内产生沉淀,D中品红溶液褪色.由此可以证明的产物有H2O、SO2、SO3.
⑤取A中剩余固体少许于试管中,加入适量稀硫酸溶解,再滴入2滴KSCN溶液,溶液变红.
(4)问题探讨:某同学取A中剩余固体少许于一支试管中,加入适量硫酸溶解,再滴加少许KMnO4溶液,发现KMnO4溶液紫红色褪去,于是认为上述实验还有FeO生成.小组讨论后否定了该同学的观点,请说明理由5.56g样品完全分解产生Fe2O3为1.6g,实验剩余固体为2.32g,说明亚硫酸铁没有分解完或有剩余.
(5)实验结论:根据实验现象得出上述猜想丁正确.
Ⅲ.定量探究:
该学习小组取ag抗贫血药物配成100mL溶液,取25.0mL于锥形瓶中,用bmol•L-1K2Cr2O7标准溶液滴定(已知该反应中Cr2O72-被还原为Cr3+,药物其它成分不与K2Cr2O7反应),平均消耗K2Cr2O7标准溶液vmL.则该抗贫血药中铁元素的质量分数为$\frac{1.344bv}{a}$×100%.(用含a、b和v的代数式表示)
分析 I.从溶液中提取绿矾经过趁热过滤,去除杂质,冷却结晶析出绿矾晶体,再过滤等操作;Fe与铁离子反应生成亚铁离子;
II.(1)依据氧化还原反应的特征化合价有升必有降来分析;
(3)③分解生成的气体充满装置,不能全部被排出;
④根据检验H2O、SO2、SO3的方法分析;
(4)根据2FeSO4•7H2O~e2O3的关系式可以计算5.56g样品完全分解产生Fe2O3为1.6g,而实际剩余固体为2.32g,说明亚硫酸铁有剩余;
(5)根据实验可知分解产物为H2O、SO2、SO3、Fe2O3;
III.滴定时发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,根据消耗的K2Cr2O7标准溶液的物质的量可以求出Fe2+的物质的量,再求出100mL溶液中Fe2+的物质的量和质量,然后求出质量分数.
解答 解:I.从溶液中提取绿矾经过趁热过滤,去除杂质,冷却结晶析出绿矾晶体,再过滤,冰水洗涤、小心烘干,得到绿矾晶体;Fe与铁离子反应生成亚铁离子,则发生的反应会有:Fe+2Fe3+=3Fe2+;
故答案为:冷却结晶;Fe+2Fe3+=3Fe2+;
II.(1)乙:Fe2O3、SO3、H2O,反应中化合价只有铁升高了,没有元素化合价的降低,不符合氧化还原反应规律,所以乙猜想肯定不成立;
故答案为:乙;
(3)③分解生成的气体充满装置,不能全部被排出,通入N2可以将生成的气体产物全部排出,被后面的试剂完全吸收;
故答案为:将分解产生的气体全部排出;
④B装置中无水硫酸铜变蓝,说明有水生成,C中锥形瓶内产生沉淀,说明有SO3,D中品红溶液褪色,说明有SO2.由此可以证明的产物有 H2O、SO2、SO3;
故答案为:H2O、SO2、SO3;
(4)根据2FeSO4•7H2O~e2O3的关系式可以计算5.56g样品完全分解产生Fe2O3为1.6g,而实际剩余固体为2.32g,剩余的固体的质量偏大,说明亚硫酸铁没有完全分解有剩余,则剩余固体中含有二价铁,所以加入适量硫酸溶解,再滴加少许KMnO4溶液,发现KMnO4溶液紫红色褪去;
故答案为:5.56g样品完全分解产生Fe2O3为1.6g,实验剩余固体为2.32g,说明亚硫酸铁没有分解完或有剩余;
(5)根据实验可知分解产物为H2O、SO2、SO3、Fe2O3,则丁的猜想正确;
故答案为:丁;
III.滴定时发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
n(Cr2O72-)=bmol•L-1×v×10-3L,则n(Fe2+)=6n(Cr2O72-)=6×bmol•L-1×v×10-3L,
所以100mL溶液中Fe2+的物质的量6×bmol•L-1×v×10-3L×$\frac{100mL}{25mL}$,
则该抗贫血药中铁元素的质量分数为$\frac{6×bmol•{L}^{-1}×v×1{0}^{-3}L×\frac{100mL}{25mL}×56g/mol}{ag}$×100%=$\frac{1.344bv}{a}$×100%;
故答案为:$\frac{1.344bv}{a}$×100%.
点评 本题考查了探究物质组成的方法,题目难度较大,试题涉及物质组成的测定、Fe及其化合物的性质、离子方程式、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力.

(1)探究铁矿石中铁的价态.
①某同学将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现血红色.由此得出该铁矿石中铁元素价态为+3的结论.你认为此结论不合理(填“合理”或“不合理”),其理由稀硝酸具有强氧化性,能将样品中的+2价的铁元素氧化为+3价.
②请完成下表对铁元素价态的探究实验:
限选试剂:3mol•L-1H2SO4溶液、3% H2O2溶液、6mol•L-1HNO3溶液、0.01mol•L-1KMnO4溶液、稀NaOH溶液、0.1mol•L-1KI溶液、20%KSCN溶液、蒸馏水.
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |
将2.25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL,利用反应5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O 对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液进行滴定,平均消耗0.02mol•L-1KMnO4溶液的体积为25.00mL,求铁矿石中铁元素的质量分数(写出计算过程,并保留3位有效数字)
②下列滴定方式中,最合理的是(夹持部分略去)b.

③在滴定过程中,不需要(填“需要”或“不需要”)指示剂来确定滴定终点.
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
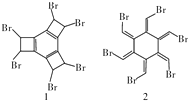
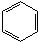
| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
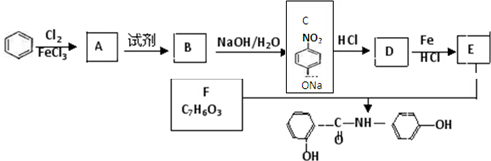
 .
. .
. 、
、 、
、 (任选两种)(写出各种结构).
(任选两种)(写出各种结构).
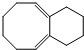 )与乙烯通过烯烃复分解进行如图所示的一系列反应:
)与乙烯通过烯烃复分解进行如图所示的一系列反应: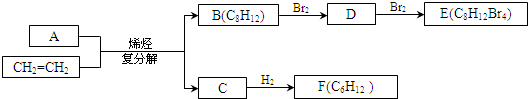
 $\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式
$\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式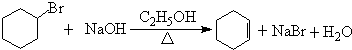

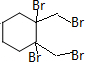 +4KOH
+4KOH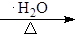
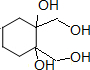 +4KBr.
+4KBr. ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
 .
.