题目内容
3.由铜、锌和稀硫酸组成的原电池中(图1):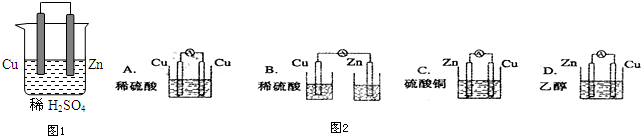
(1)锌是负极,电极反应式是Zn-2e-═Zn2+.铜是正极,电极反应式是2H++2e-=H2↑.总反应式Zn+2H+=Zn2++H2↑
(2)在铜极上可以观察到有气泡产生,在锌极可以观察到锌片逐渐溶解(填实验现象)
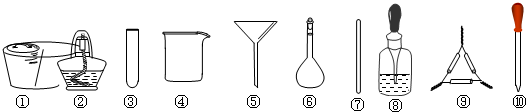
(3)图2装置能够组成原电池是C.
分析 (1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应;
(2)铜、锌、稀硫酸原电池中,锌易失电子溶解发生氧化反应,铜作正极,正极上氢离子得电子生成氢气;
(3)根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:(1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-═Zn2+,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,总反应为Zn+2H+=Zn2++H2↑,
故答案为:负;Zn-2e-═Zn2+;正;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,所以铜极上可以观察到有气泡产生;锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-═Zn2+,所以锌极可以观察到锌片逐渐溶解;
故答案为:有气泡产生;锌片逐渐溶解;
(3)A、两个电极材料相同且不能自发的进行氧化还原反应,故A错误.
B、没有形成闭合回路,故B错误.
C、符合原电池的构成条件,故C正确.
D、乙醇不是电解质溶液且不能自发的进行氧化还原反应,故D错误.
故选C.
点评 本题考查了原电池原理以及形成原电池的条件,明确正负极的判断方法、正负极上电极反应即可解答,难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
11.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
18. 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
8.有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A、D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是为( )
| A. | A>B>D>C | B. | B>D>A>C | C. | D>B>A>C | D. | D>A>B>C |
12.海带中碘元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )

| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.lmol•L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: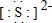 .
.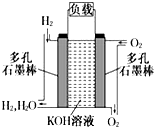 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: