题目内容
10.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
分析 A.H2O分子间存在氢键,熔点较高;
B.非金属性越强,氢化物越稳定;
C.Cs的颜色略显金色;
D.酸性条件下,硝酸根离子能把二氧化硫氧化为硫酸根.
解答 解:A.ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4,H2O分子间存在氢键,熔点较高,则ⅥA族元素氢化物熔点顺序为:H2O>H2Se>H2S,故A错误;
B.非金属性越强,氢化物越稳定,非金属性F>O>N,Cl>S>P,则氢化物的稳定性:HF>H2O>NH3,HCl>H2S>PH3,故B正确;
C.Na为白色金属,Cs的颜色略显金色,二者颜色不同,故C错误;
D.BaCl2溶液中通入SO2无沉淀产生,酸性条件下,硝酸根离子能把二氧化硫氧化为硫酸根,所以Ba(NO3)2溶液中通入SO2会生成硫酸钡沉淀,故D错误.
故选B.
点评 本题考查了元素周期律、碱金属、二氧化硫的性质、氢键等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
20.物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸溶液反应的溶液中,pH最大的是( )
| A. | Na2CO3溶液 | B. | Na[Al(OH)4]溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
1.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染.其电池反应为2Zn+O2═2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
18. 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
5.下列各组中,每种电解质溶液电解时电解水类型的是( )
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
2.我国在世界上最先应用湿法冶金术冶炼的金属是( )
| A. | Fe | B. | Cu | C. | Ag | D. | Hg |
20.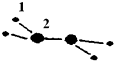 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.
(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:从平衡表达式可以看出,当c(NH3•H2O)、c(Mg2+)改变相同的程度,c2(NH3•H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH-)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH-)<Ksp[Mg(OH)2].
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[ClO-]b[OH-]c(温度一定时,k为常数).
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
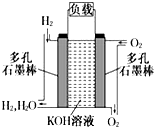 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: