题目内容
10.碳元素是形成单质及其化合物种类最多的元素.回答下列有关问题.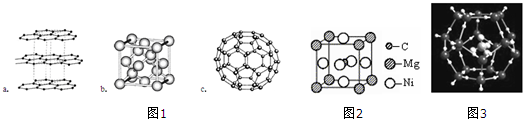
(1)碳元素可形成多种不同形式的单质,图1是几种单质的结构图,观察上述结构,判断a中碳原子的杂化方式为sp2,b对应的物质是金刚石,c是C60的分子结构模型,在每个C60分子中形成的σ键数目为90.
(2)在C60单质中,微粒之间的作用力为分子间作用力,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1:3,则K3C60属于离子晶体.
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为C≡O;写出另一与CO互为等电子体的化学式CN-.
(4)CO可以和很多过渡金属形成配合物.金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4 的结构为
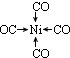 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图2,则该化合物的化学式为MgNi3N;C、Ni、Mg三种元素中,电负性最大的是C.
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源.可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如图3所示).两种分子中,共价键的键能H-O键>C-H键;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是H2O分子之间形成氢键.
分析 (1)a为石墨,每个C原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型,b为正四面体结构,则对应的物质是金刚石,c是C60的分子结构模型,平均每个C形成1.5个σ键;
(2)C60单质为分子晶体,微粒之间的作用力为分子间作用力,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1:3,则K3C60属于离子晶体;
(3)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键;等电子体中原子数和价电子数都相同;
(4)根据配合物Ni(CO)4的Ni为中心原子,CO为配体表示Ni(CO)4 的结构,Ni元素是28号元素,根据核外电子排布规律书写基态原子的电子排布式;
(5)根据均摊法计算晶胞中各原子数目,进而确定化学式;电负性最大的即非金属性最强;
(6)根据键长越短键能越大判断;H2O分子间形成氢键.
解答 解:(1)a为石墨,每个C原子价层电子对个数是3,根据价层电子对互斥理论知C原子杂化类型为sp2;b为正四面体结构,则对应的物质是金刚石,c是C60的分子结构模型,平均每个C形成1.5个σ键,所以在每个C60分子中形成的σ键数目为60×1.5=90;
故答案为:sp2;金刚石; 90;
(2)C60单质为分子晶体,微粒之间的作用力为分子间作用力,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1:3,则K3C60属于离子晶体;故答案为:分子间作用力; 离子;
(3)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,等电子体中原子数和价电子数都相同,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,故答案为:C≡O;CN-;
(4)配合物Ni(CO)4的Ni为中心原子,CO为配体,所以表示Ni(CO)4 的结构为 ;Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2,故答案为:
;Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2,故答案为: ,1s22s22p63s23p63d84s2;
,1s22s22p63s23p63d84s2;
(5)晶胞中N原子数目为1、Mg原子数目为8×$\frac{1}{8}$=1、Ni原子数目为6×$\frac{1}{2}$=3,故该晶体化学式为MgNi3N,电负性最大的即非金属性最强,所以C、Ni、Mg三种元素中,电负性最大的是C,故答案为:MgNi3N;MgCNi3;C;
(6)因为键长越短键能越大,又O的半径小于C,所以共价键的键能H-O键>C-H键;又H2O分子间形成氢键,所以CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大;故答案为:>;H2O分子之间形成氢键.
点评 本题是对物质结构的考查,涉及元素周期表、晶胞计算、分子结构、杂化轨道、配合物等,难度中等,需要学生具备扎实的基础.

| A. | 0.5amol | B. | 0.1amol | C. | 0.1+amol | D. | 2amol |
| A. | 碳原子核外电子有六种运动状态 | B. | NH4+ 中N原子轨道杂化类型为sp3 | ||
| C. | 电负性:O>Cl | D. | 第一电离能 Al>Mg |
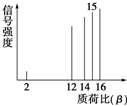 质谱法能够对有机分子进行结构分析.其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比.其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),该有机物可能是( )
质谱法能够对有机分子进行结构分析.其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室,样品分子大量离子化,少量分子碎裂成更小的离子,然后测定其质荷比.其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),该有机物可能是( )| A. | 甲醇(CH3OH) | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
| A. | 在周期表中,主族元素的主族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强 | |
| C. | 同主族元素随着原子的核电荷数的递增,原子半径依次增大 | |
| D. | 主族元素的单质,随相对分子质量的增大,熔、沸点升高 |

| A. | 该反应的热化学方程式:N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=(a+b) kJ•mol-1 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 | |
| D. | T1>T2,且正反应为吸热反应 |