题目内容
18.下列描述不正确的是( )| A. | 碳原子核外电子有六种运动状态 | B. | NH4+ 中N原子轨道杂化类型为sp3 | ||
| C. | 电负性:O>Cl | D. | 第一电离能 Al>Mg |
分析 A.原子核外电子运动状态和该原子的核外电子数相等;
B.根据价层电子对=σ 键电子对+中心原子上的孤电子对判断;
C.同周期元素从左到右,元素的电负性逐渐增强,同主族元素从上到下,元素的电负性逐渐变小;
D.Mg的3s电子全满,为稳定结构.
解答 解:A.C原子具有6个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有6种不同的运动状态,故A正确;
B.NH4+离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,故B正确;
C.同周期主族元素从左到右,元素的电负性逐渐增大,同主族元素从上到下,元素的电负性逐渐变小,则电负性O>Cl,故C正确;
D.Mg的3s电子全满,为稳定结构,Mg难失去1个电子,则第一电离能:Al<Mg,故D错误;
故选D.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,涉及第一电离能、杂化类型判断及电负性比较等,注意结构与性质的关系是解答本题的关键,侧重选修三知识点的考查,题目难度中等.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
9.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| B. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| C. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| D. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 |
13.下列关于苯酚的说法中,不正确的是( )
| A. | 纯净的苯酚是粉红色的晶体 | |
| B. | 有特殊的气味 | |
| C. | 易溶于乙醇、乙醚等有机溶剂,不易溶于冷水 | |
| D. | 苯酚有毒,沾在皮肤上,可用浓NaOH溶液洗涤 |
7.下列物质中含有共价键的离子化合物是( )
| A. | Ba(OH)2 | B. | H2O | C. | O2 | D. | CaCl2 |
8.下列说法中不正确的是( )
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯( )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
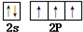 .
.
 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.