题目内容
19.T℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ) 所示.若保持其他条件不变,温度分别为T1℃和T2℃时,NH3的体积分数与时间关系如图(Ⅱ)所示.则下列结论正确的是( )
| A. | 该反应的热化学方程式:N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=(a+b) kJ•mol-1 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 | |
| D. | T1>T2,且正反应为吸热反应 |
分析 A、反应热=生成物的总能量-反应物的总能量,据此结合图象判断反应热,书写热化学方程式;
B、反应热=生成物的总能量-反应物的总能量,据此结合图象判断反应热,书写热化学方程式;
C、由图可知该反应为放热反应,升高温度,正、逆反应速率均增大,平衡向逆反应移动;
D、温度为Tl先到达平衡,故温度Tl>T2,温度越高,氨气的体积分数越小,平衡向逆反应移动.
解答 解:A、由图Ⅰ可知,生成氨气(l)的反应热为-(b+c-a)kJ/mol,热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l);△H=-(b+c-a)kJ•mol-1,即为N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1,故A正确;
B、由图Ⅰ可知,生成氨气(g)的反应热为-(b-a)kJ/mol,热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g);△H=-(b-a)kJ•mol-1,故B错误;
C、该反应为放热反应,升高温度,正、逆反应速率均增大,平衡向逆反应移动,H2的转化率降低,故C错误;
D、温度为Tl先到达平衡,故温度Tl>T2,温度越高,氨气的体积分数越小,平衡向逆反应移动,故正反应为放热反应,故D错误.
故选A.
点评 考查热化学方程式书写、物质能量与反应热关系、化学平衡图象及影响因素等,难度中等,注意能量与反应过程关系图象的理解.

练习册系列答案
相关题目
9.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| B. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| C. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| D. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 |
7.下列物质中含有共价键的离子化合物是( )
| A. | Ba(OH)2 | B. | H2O | C. | O2 | D. | CaCl2 |
14.下列实验操作不正确的是( )
| A. | 配制银氨溶液:向氨水中加入过量的硝酸银溶液 | |
| B. | 银镜反应:向银氨溶液中滴加葡萄糖溶液后,热水浴 | |
| C. | 检验蔗糖的水解产物:先加碱中和,再滴入新制的氢氧化铜中加热 | |
| D. | 淀粉水解:向淀粉溶液中加入唾液,加热 |
4.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 |
11.固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L-1,c(HI)=3mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 12 | B. | 16 | C. | 20 | D. | 25 |
8.下列说法中不正确的是( )
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(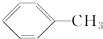 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
9.(1)Ⅰ.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIA族.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.