题目内容
1.将3.2gCu跟30mL10mol/LHNO3充分反应,还原产物为NO、NO2.若反应后溶液中有amolH+,则此时溶液中含硝酸根离子的物质的量为( )| A. | 0.5amol | B. | 0.1amol | C. | 0.1+amol | D. | 2amol |
分析 铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量.
解答 解:3.2g的物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--Cu--2NO3-
1 2
0.05mol x
$\frac{1}{2}=\frac{0.05mol}{x}$,解得x=0.1mol,
HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a)mol,
故选C.
点评 本题考查的是硝酸的性质及守恒法的计算,为高频考点,把握原子守恒的计算为解答的关键,在做题时要灵活运用,不能生搬硬套,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
12.下列说法中错误的是( )
| A. | 通常蔗糖和淀粉都不显还原性 | |
| B. | 纤维素分子是由葡萄糖单元组成的,可以表现出一些多元醇的性质 | |
| C. | 油脂是热能最高的营养物质 | |
| D. | 铜盐可以使蛋白质产生盐析 |
9.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| B. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| C. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| D. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 |
16.某化合物由A、B两元素组成,已知A、B两元素质量比为7:4,原子量比为7:8,则化合物可能是( )
| A. | A2B | B. | AB2 | C. | AB3 | D. | A2B5 |
13.下列关于苯酚的说法中,不正确的是( )
| A. | 纯净的苯酚是粉红色的晶体 | |
| B. | 有特殊的气味 | |
| C. | 易溶于乙醇、乙醚等有机溶剂,不易溶于冷水 | |
| D. | 苯酚有毒,沾在皮肤上,可用浓NaOH溶液洗涤 |
 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是 浓度为0.5 mol·L-1 D.2 min末时B的浓度为1.5 mol·L-1
浓度为0.5 mol·L-1 D.2 min末时B的浓度为1.5 mol·L-1
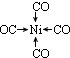 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.