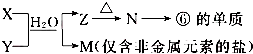题目内容
20.已知2X2(g)+Y2(g)?2Z(g)△H=-a kJ/mol(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为Wmol/L,放出热量b kJ.(1)此反应平衡常数表达式为$\frac{c{\;}^{2}(Z)}{c{\;}^{2}(X{\;}_{2})×c(Y{\;}_{2})}$;若将温度降低到300℃,则反应平衡常数将增大(填增大、减少或不变).
(2)若原来容器中只加入2molZ,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度为=mol/L(填“>”、“<”或“=”),a、b、c之间满足关系a=b+c(用代数式表示).
(3)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将变大(填“变大”、“变小”或“不变”).
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
该反应正反应是放热反应,降低温度,平衡向正反应移动,平衡常数增大;
(2)恒温恒容下,2molZ完全转化到左边,可得2molX2和1molY2,故与原平衡为等效平衡,平衡时Z的浓度相同;
同一可逆反应,相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,根据反应热计算两个过程的热量数值,据此判断;
(3)原平衡随反应进行,压强降低.恒压容器(反应器开始体积相同),相同温度下起始加入2molX2和1molY2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,据此判断.
解答 解:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以2X2(g)+Y2(g)?2Z(g)的平衡常数k=$\frac{c{\;}^{2}(Z)}{c{\;}^{2}(X{\;}_{2})×c(Y{\;}_{2})}$,该反应正反应是放热反应,降低温度,平衡向正反应移动,平衡常数增大,
故答案为:$\frac{c{\;}^{2}(Z)}{c{\;}^{2}(X{\;}_{2})×c(Y{\;}_{2})}$;增大;
(2)恒温恒容下,2molZ完全转化到左边,可得2molX2和1molY2,故与原平衡为等效平衡,平衡时Z的浓度相同,故c(Z)=Wmol•L-1,
同一可逆反应,相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,
对于反应2X2(g)+Y2(g)?2Z(g)△H=-akJ•mol-1,则b=n×$\frac{a}{2}$,对于反应2Z(g)?2X2(g)+Y2(g)△H=akJ•mol-1,Z分解的物质的量为(2-n)mol,故c=$\frac{2-n}{2}$×a=1-n×$\frac{a}{2}$,故a=b+c,
故答案为:=;a=b+c;
(3)原平衡随反应进行,压强降低.恒压容器(反应器开始体积相同),相同温度下起始加入2molX2和1molY2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,即向正反应移动,Y2的转化率变大,故答案为:变大.
点评 本题考查化学平衡常数、平衡状态判断,化学平衡的有关计算等,注意(3)中构建平衡建立的途径,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 12 | B. | 16 | C. | 20 | D. | 25 |
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(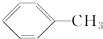 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
| A. | 将少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亚铁溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管以及等质量的几片滤纸.
(2)计算.配制该溶液需取NaCl晶体的质量为14.6g.
(3)称量.
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解.该步实验中需要使用玻璃棒,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2~3次是保证溶质全部转移至容量瓶中.
(6)定容,摇匀.
(7)在配制溶液(或者稀释浓溶液)的过程中,存在引起误差的一些错误操作,可能造成所配溶液的浓度会受到影响,请完成表格(在空格处填偏大、偏小或者无影响).
| 引起误差的一些错误操作 | 对CB的影响 |
| 定容时,俯视刻度线 | 偏大 |
| 转移溶液时,玻璃棒下端靠在容量瓶刻度线以上 | 偏小 |
| 洗涤量取浓溶液的量筒并将洗涤液转移到容量瓶 | 偏大 |
| 定容后,经振荡、摇匀、静置、液面低于刻度线再加水 | 偏小 |
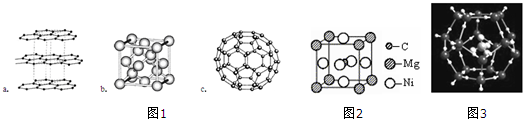
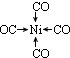 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2. 、
、 .
.
 或
或 .
.