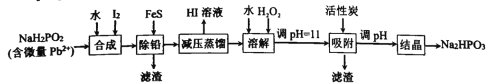
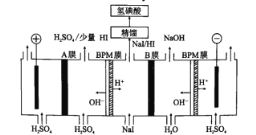
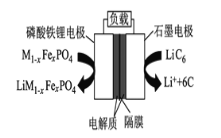
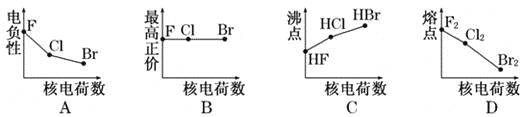
题目内容
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
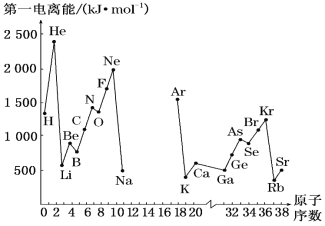
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
【答案】Na Mg 第五周期ⅠA族 0.9~1.5 A BCD 测定各物质在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物
【解析】
(1) ①根据曲线图,同一周期第一电离能随着原子序数的增大呈增大趋势,但第IIA族、第VA族反常,故Al的第一电离能的大小范围在Na、Mg两种元素之间;
②同一周期第一电离能随着原子序数的增大呈增大趋势,但第IIA族、第VA族反常;同主族从上到下第一电离能逐渐减小,故图中第一电离能最小的元素为Rb,Rb在周期表中的位置是第五周期ⅠA族;
(2)①根据曲线图,同周期电负性随原子序数的增大而增大,同主族从上到下电负性逐渐减小,故Mg元素电负性值的最小范围0.9~1.5;
②两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键;Li3N中N与Li电负性的差值为3.0-1.0=2.0>1.7,属于离子化合物;BeCl2中Cl与Be电负性的差值为3.0-1.5=1.5<1.7,属于共价化合物;AlCl3中Cl与Al电负性的差值为3.0-1.5=1.5<1.7,属于共价化合物;SiC中C与Si的电负性差值为2.5-1.8=0.7<1.7,属于共价化合物;要证明化合物是共价化合物还是离子化合物,只要证明该化合物在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】(1)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)2NH3(g)△H。有关键能数据如下:
化学键 | H-H | N-H | N≡N |
键能)kJ/mol) | 436 | 391 | 945 |
根据表中所列键能数据可得△H=____________。
(2)已知:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0kJ/mol,表示氢气燃烧热的热化学方程式为______________。
(3)已知化学反应A(g)+B(g)C(g)+D(g),900℃时向一个体积为2L的密闭容器中充入0.20mol A和0.80mol B,2s时达到平衡,A的浓度变化0.05mol/L,则A的平均反应速率v(A) =________,平衡时B的转化率为____ ,C的体积百分数为_______ 。
(4)CO、H2可用于合成甲醇和甲醚,其反应为(m、n均大于![]() ):
):
反应①:CO(g)+2H2(g)CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=-n kJ/mol
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
根据上述的热化学方程式可以判断则2m_____n(填“大于”、“小于”、“等于”或“无法确定”)。
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a