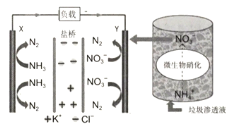
题目内容
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
【答案】D
【解析】
A.①、②中反应温度相同,平衡常数K的数值相同,A项错误;B.①中反应放热0.1akJ,说明10min内X2反应了0.1mol,物质的量浓度改变量为0.1mol/L,所以其平均速率为υ(X2)=0.01mol/(L·min),B项错误;C.据容器①中数据,可算出X2的平衡转化率为10%,容器②中是恒温恒压,容器①是恒温恒容,容器②相当于在容器①基础上加压,加压平衡右移,所以X2的转化率大于10%,C项错误;D.据C项分析,容器②相当于在容器①基础上右移,所以放出热量比容器①多,D项正确;答案选D项。

【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
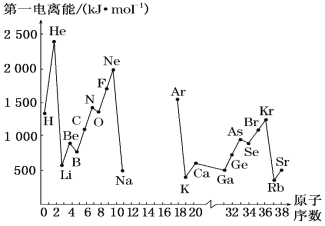
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%