题目内容
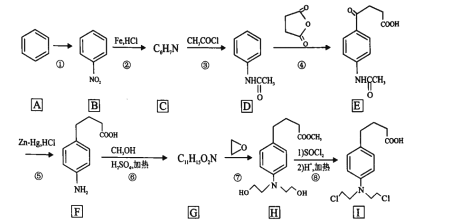
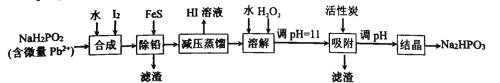
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。
(4)“调pH=11”的作用是______________。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________(填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
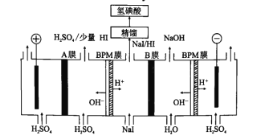
①B膜最佳应选择______________
②阳极的电极反应式是____。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________。
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s) NaH2PO3 将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3 9.8 Na+交换膜 2H2O-4e-=O2↑+4H+ I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;
“除铅”步骤,FeS将Pb2+转化为PbS除去,同时得到Fe2+;
“减压蒸馏”因为HI易挥发,H3PO3和NaI反应生成HI和NaH2PO3,同时获得HI;
“溶解”阶段,H2O2将Fe2+氧化成Fe3+;
“调pH=11”将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;
“调pH”将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答。
(1) “合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI,反应方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI,故答案为:NaH2PO2+I2+H2O=H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s),故答案为:FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s);
(3)由上面的分析可知,“减压蒸馏”过程,除得到HI回收I-外,H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3,故答案为:NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3,故答案为:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)H3PO3的pKa1=1.3,pKa2=6.6,说明H3PO3是二元弱酸,则HPO32-的水解常数Kh=![]() =10-7.4,
=10-7.4,![]() ,水解是微弱的,所以10-7.4
,水解是微弱的,所以10-7.4![]() ≈
≈![]() =
=![]() ,解得:c(OH-)=10-4.2mol/L,c(H+)=
,解得:c(OH-)=10-4.2mol/L,c(H+)=![]() =10-9.8mol/L,所以,pH=9.8,故答案为:9.8;
=10-9.8mol/L,所以,pH=9.8,故答案为:9.8;
(6)①从图上看,右端的BPM膜和B膜之间产生NaOH,BPM膜提供OH-,B膜最好是Na+交换膜,故答案为:Na+交换膜;
②阳极附近溶液为硫酸溶液,水电离的氢氧根失电子,故阳极的电极反应式为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
③A膜应为阳离子交换膜,阳极产生的H+透过A膜和少量的I-得到少量的HI,若撤去A膜,I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板,故答案为:I-会在阳极失电子得到单质,沉积在阳极表面,损伤阳极板。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
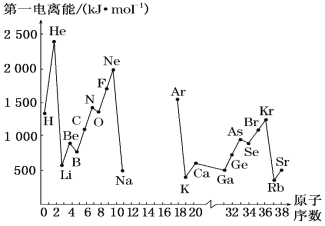
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____