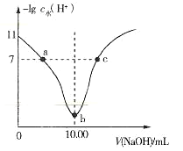
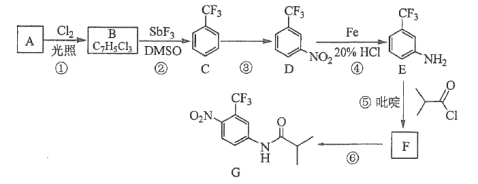
题目内容
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
【答案】B
【解析】
A.在相同能层中,p轨道电子的能量一定比s轨道电子的能量高,但不同能层中p轨道电子能量不一定高于s轨道电子能量,如2p轨道电子的能量就低于3s轨道电子的能量,A不正确;
B.基态Fe原子的价电子排布式为3d64s2,其轨道表示式为![]() ,B正确;
,B正确;
C.虽然氧元素电负性比氮元素大,但由于氮原子的2p轨道电子半充满,电子的能量低,原子稳定,所以第一电离能出现反常,即氮原子第一电离能比氧原子第一电离能大,C不正确;
D.根据原子核外电子排布的特点,Cu的价电子先进入4s轨道,后进入3d轨道,所以Cu在周期表中属于ds区元素,D不正确;
故选B。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
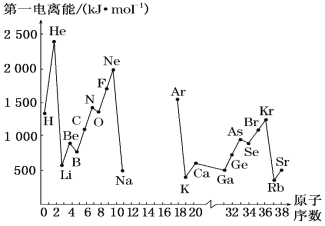
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____