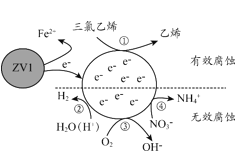
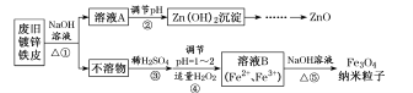
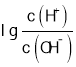题目内容
【题目】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____区,Fe3+的价电子排布式为 ____。
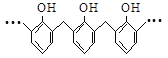
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____。1 mol[Cu(en)2]C12中含有σ键的数目为____。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为 ___。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________。
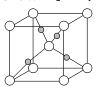
(4)如图为Cu2O的晶胞结构,其中黑球表示____原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___cm。(用NA表示阿伏加德罗常数的值)
【答案】d 3d5 4 26NA sp2 H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,更易电离出H+ Cu 
【解析】
(1)元素周期表五区的划分是根据最后排入的电子名称命名的,Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,根据能量最低原理先排4s电子后排3d电子,所以最后排入的是3d电子,根据命名规则属d区,Fe3+的价电子排布式为3d5,故答案为:d;3d5;
(2)乙二胺中含有2个N原子,根据化学式[Cu(en)2]2+知,其中Cu2+的配位数为2×2=4;单键为σ键,配位键也属于σ键,所以1mol[Cu(en)2]C12中含有σ键的物质的量为1mol×(11×2+4)=26mol,即26NA;故答案为:4;26NA;
(3)SeO3的中心原子价层电子对数为![]() ,则Se原子的杂化轨道类型为sp2;H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,更易电离出H+,所以H2SeO4比H2SeO3酸性强,故答案为:sp2;H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,更易电离出H+;
,则Se原子的杂化轨道类型为sp2;H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,更易电离出H+,所以H2SeO4比H2SeO3酸性强,故答案为:sp2;H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,更易电离出H+;
(4)根据晶胞结构分析,白球处于顶点和体心,则属于该晶胞的白球原子数为8×![]() +1=2,属于该晶胞的黑球数目为4,该晶胞化学式为Cu2O,则黑球表示Cu;设晶胞的边长为d,则
+1=2,属于该晶胞的黑球数目为4,该晶胞化学式为Cu2O,则黑球表示Cu;设晶胞的边长为d,则![]() =
=![]() ,故d=
,故d= ,故答案为:Cu;
,故答案为:Cu; 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:
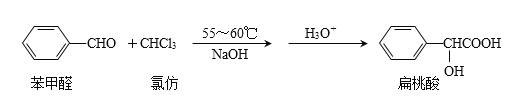
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
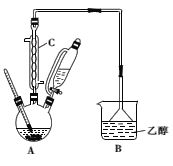
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。