题目内容
【题目】T℃ 时,在一容积为 2 L 的恒容密闭容器中加入 2 mol A 和 3 mol B,压强为 P0, 在催化剂存在的条件下进行下列反应:2A(g)+3B(g) 3C(g),2 分钟达到平衡,平衡混合气中 C 的体积分数为 37.5%。 已知该反应某一时刻的瞬时速率计算公为v正=k正·[A]2·[B]3,v逆=k逆·[C]3,其中 k正、k逆为速率常数。
(1)计算上述条件下 ![]() 的值。 (写出必要的计算过程,下同)_____
的值。 (写出必要的计算过程,下同)_____
(2)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数,记作 Kp。已知某气体分压(P分)=气体总压(P总) ×该气体的物质的量分数,计算 T℃ 时上述反应 Kp 的值(用含 P0 的数值表示)。____________
【答案】4 ![]()
![]()
【解析】
(1)利用“三段式”计算出平衡常数K,根据已知条件v正=k正·[A]2·[B]3,v逆=k逆·[C]3,平衡时正逆反应速率相等,列式解答;
(2)各物质分压=总压×平衡时各物质的物质的量分数,据此书写压强表示的平衡常数。
(1)设达到平衡时 A 转化的物质的量为 x mol
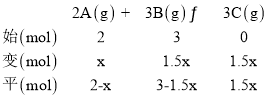
由题知![]() ×100%=37.5%得 x=1,
×100%=37.5%得 x=1,![]() ,反应达到平衡时满足 v正=v逆,即 k正[A]2[B]3=k逆[C]3,得
,反应达到平衡时满足 v正=v逆,即 k正[A]2[B]3=k逆[C]3,得![]() =K=4;
=K=4;
(2)平衡时 n(A)=1 mol,n(B)=1.5 mol,n(C)=1.5 mol,A、B、C 气体的物质的量分数分别为 25%,37.5%,37.5%。起始压强为 P0,则达平衡后压强为 0.8P0,则Kp=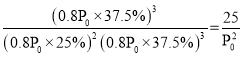 。
。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定