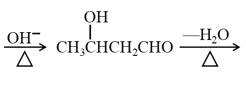题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环烷的混合气体中含有的碳原子数为2NA
B.2.0gD2O中含有的质子数、电子数均为NA
C.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
D.含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
【答案】C
【解析】
C.Fe和HNO3反应有四种情况,①和稀硝酸反应,Fe过量,氧化产物是Fe(NO3)2且HNO3反应完全,此时![]() 计算;②和稀硝酸反应,HNO3过量,Fe完全反应,氧化产物是Fe(NO3)3,此时用
计算;②和稀硝酸反应,HNO3过量,Fe完全反应,氧化产物是Fe(NO3)3,此时用![]() ;③和浓硝酸反应,Fe过量,HNO3反应完,氧化产物是Fe(NO3)2,还原产物是NO2,此时用
;③和浓硝酸反应,Fe过量,HNO3反应完,氧化产物是Fe(NO3)2,还原产物是NO2,此时用![]() 计算;④和浓硝酸反应, HNO3过量,Fe反应完,氧化产物是Fe(NO3)3,还原产物是NO2,此时用
计算;④和浓硝酸反应, HNO3过量,Fe反应完,氧化产物是Fe(NO3)3,还原产物是NO2,此时用![]() 计算。本题中n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8﹥1:4﹥1:6,也就是说,Fe一定过量,那么就只需要考虑Fe过量、硝酸反应完的两种情况了。
计算。本题中n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8﹥1:4﹥1:6,也就是说,Fe一定过量,那么就只需要考虑Fe过量、硝酸反应完的两种情况了。
A.乙烯(C2H4)和环烷(CnH2n)最简式都为CH2,可看成混合物由一定物质的量的CH2组成,CH2的物质的量n=![]() =2mol,n(C)=2mol
=2mol,n(C)=2mol![]() 1=2mol,所以碳原子数为2NA,A正确;
1=2mol,所以碳原子数为2NA,A正确;
B.D2O即![]() ,所以n(D2O)=
,所以n(D2O)=![]() =0.1mol,n(质子)=0.1mol×10=1mol,n(电子)=0.1mol×10=1mol,质子数、电子数均为NA,B正确;
=0.1mol,n(质子)=0.1mol×10=1mol,n(电子)=0.1mol×10=1mol,质子数、电子数均为NA,B正确;
C.假设硝酸是稀硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8,铁过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算,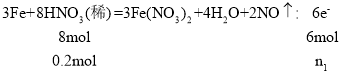 ,解得n1=0.15mol,假设硝酸是浓硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥1:4,Fe过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算
,解得n1=0.15mol,假设硝酸是浓硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥1:4,Fe过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算 ,解得n2=0.1mol,C错误;
,解得n2=0.1mol,C错误;
D.电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),中性时:c(H+)=c(OH-),所以c(NH4+)= (Cl-),D正确。
答案选C。

【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定