题目内容
【题目】常温下,用0.0100 mol/L的NaOH溶液滴定10. 00 mL 0.0100 mol/L的二元酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中的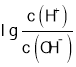 关系如图所示,下列说法正确的是( )
关系如图所示,下列说法正确的是( )

A.H2A的电离方程式为:H2A=A2-+2H+
B.B点显酸性的原因是HA的电离程度大于其水解程度
C.C点溶液显中性,所以 c(Na+)=c(A2-) +c(HA-)
D.常温下Kh(Na2 A)的数量级约为10-4
【答案】D
【解析】
A. A点,0.01mol/L的H2A,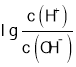 =10,则
=10,则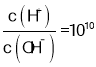 ,c(H+)=
,c(H+)=![]() mol/L,则H2A不完全电离,电离方程式为:H2A
mol/L,则H2A不完全电离,电离方程式为:H2A![]() HA-+H+,HA-
HA-+H+,HA-![]() A2-+H+,故A错误;
A2-+H+,故A错误;
B. B点时,溶质为NaHA,溶液显酸性的原因是HA-的电离程度大于其水解程度,故B错误;
C. C点溶液显中性,则c(H+)=c(OH-),根据电荷守恒知:c(Na+)+ c(H+)=2c(A2-)+c(HA-)+c(OH-),所以 c(Na+)=2c(A2-)+c(HA-),故C错误;
D. D点时,溶质Na2 A,此时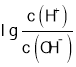 =-8,则
=-8,则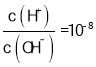 ,根据水的离子积计算得c(OH-)=10-3mol/L,根据A2-+H2O -
,根据水的离子积计算得c(OH-)=10-3mol/L,根据A2-+H2O -![]() HA-+OH-得,常温下Kh (Na2A)=
HA-+OH-得,常温下Kh (Na2A)=![]() ,故D正确;
,故D正确;
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目