题目内容
8.用0.01mol/L硫酸滴定0.01mol/L烧碱溶液,中和后加水至100mL.若滴定至终点时判断有误,甲多加了一滴硫酸,而乙则少加了一滴硫酸(20滴为1mL),则甲和乙最终c(H+)的比值为( )| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
分析 一滴0.01mol/L H2SO4的物质的量为n(H2SO4)=0.01mol/L×0.05×10-3L=5×10-7mol;多滴了一滴硫酸,滴完后溶液中氢离子浓度c(H+)=(5×10-7mol×2)÷0.01L=10-4mol/L;少滴了一滴硫酸,溶液中n(OH-)等于少滴的1滴硫酸中的氢离子物质的量,即溶液中c(OH-)=10-5mol/L,再根据水的离子积计算溶液中c(H+).
解答 解:甲中多加了1滴H2SO4,溶液显示酸性,一滴硫酸中n(H2SO4)=0.01mol/L×0.05×10-3L=5×10-7mol,溶液中c(H+)=(5×10-7mol×2)÷0.1L=10-5mol/L;
乙中少滴了一滴硫酸,溶液显碱性,n(OH-)等于1滴硫酸的物质的量,则溶液中c(OH-)=10-5mol/L,该溶液中c(H+)=10-9mol/L,
则甲和乙最终c(H+)的比值为10-5mol/L:10-9mol/L=1×104,
故选D.
点评 本题考查中和滴定误差分析、物质的量浓度有关计算,难度适中,有利于基础知识的巩固.

练习册系列答案
相关题目
3.关于化学键的下列叙述中,不正确的是( )
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
13.新制氯水中存在的微粒是( )
| A. | Cl2、HClO、HCl、H2O | |
| B. | Cl、Cl-、Cl2、H2O | |
| C. | Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- | |
| D. | Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
20.下列物质分类正确的是( )
| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
11.反应2SO2+O2?2SO3达到平衡后,再向反应容器中充入含氧的同位素的氧气,经过一段时间后,原子存在于( )
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.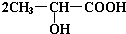 +Na2CO3→
+Na2CO3→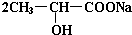 +H2O+CO2↑.
+H2O+CO2↑. .
.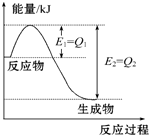 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.