题目内容
【题目】下列提纯物质方法正确的是( )
A.用BaCl2溶液除去HNO3溶液中的少量H2SO4
B.用NaOH溶液除去铝粉中的少量铁粉
C.用氯水除去FeCl2溶液中的少量FeCl3
D.用加热法除去NaCl固体中的少量NH4Cl
【答案】D
【解析】A.应加入硝酸钡,用氯化钡,与硫酸反应生成盐酸,则引入新杂质,故A不符合题意;
B.加入氢氧化钠,与铝粉反应,应用磁铁除杂,故B不符合题意;
C.氯气和FeCl2反应生成FeCl3,应加入铁粉除杂,故C不符合题意;
D.NH4Cl不稳定,加热易分解,可用加热的方法分离,故D符合题意.
所以答案是:D.

【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
A.AB.BC.CD.D
【题目】CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | a |
(1)上述反应的逆反应是(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)2CO(g) K
C(s)+H2O (g)H2(g)+CO(g) K1
CO(g)+H2O (g)H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是 .
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为molL﹣1min﹣1 , 800℃时a= .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(molL﹣1)如表,其中达到平衡状态的是(填字母).
A | B | C | D | |
c(CO2) | 3 | 1 | 0.8 | 1 |
c(H2) | 2 | 1 | 0.8 | 1 |
c(CO) | 1 | 2 | 3 | 0.5 |
c(H2O) | 2 | 2 | 3 | 2 |
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
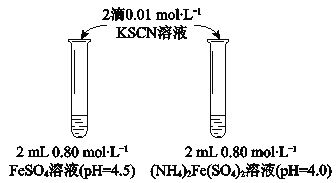
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
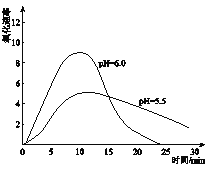
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。