题目内容
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
A.AB.BC.CD.D
【答案】C
【解析】
A.乙烯与酸性高锰酸钾反应生成二氧化碳,引入新杂质,应用溴水除杂,选项A错误;
B.苯不溶于水,加入氢氧化钠溶液后溶液分层,应用分液的方法分离,选项B错误;
C.乙酸与生石灰反应,加热时乙醇易挥发,可用蒸馏的方法分离,选项C正确;
D.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,应用分液的方法分离,选项D错误;
答案选C。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
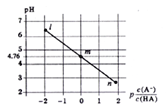
走进文言文系列答案【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①写出制取氯气的化学方程式______________。
②该装置的不足之处除无尾气吸收装置外,另一处是______________。
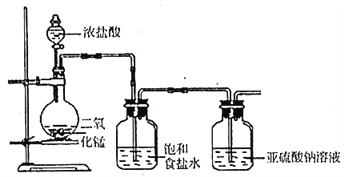
③Cl2与Na2SO3溶液反应的离子方程式为____________。
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化_________。
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
实验试剂 | 试管I | 试管II | 试管Ⅲ | 试管IV |
乙酸乙酯/mL | 1 | V1 | V2 | V3 |
1mol/LNaOH/mL | V4 | 3 | 0 | V5 |
蒸馏水/mL | 0 | V6 | 5 | 2 |
⑤请完成上表,其中V2=______,V4=______,V5=_______。
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是____;实验中,试管IV比试管II中的酯层减少更快,其原因有:温度高速率快,还可能有_________。 (乙酸乙酯沸点为77.1℃)
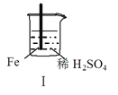
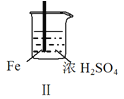
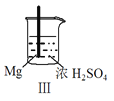
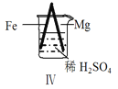
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强