题目内容
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
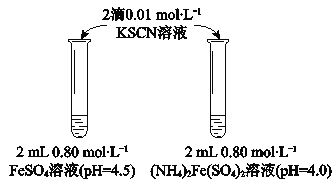
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
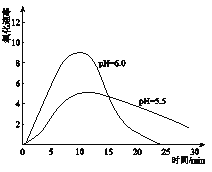
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。
【答案】 < 二价铁被氧化,4Fe2+ + O2 + 4H+=4Fe3+ + 2H2O,生成硫氰化铁,Fe3+ + 3SCN-=Fe(SCN)3 取2 mL pH=4.0的0.80 mol·L-1 FeSO4溶液 加2滴0.01 mol·L-1 KSCN溶液 溶液pH越小,Fe2+越稳定 溶液中存在平衡4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定 生成的Fe(OH)3对反应有催化作用 加一定量的酸 密封保存
4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定 生成的Fe(OH)3对反应有催化作用 加一定量的酸 密封保存
【解析】(1)加入KSCN溶液检验Fe3+,出现红色的时间越短,对应物质越不稳定,根据表中时间,FeSO4溶液中先出现红色,溶液的稳定性:FeSO4![]() (NH4)2Fe(SO4)2。
(NH4)2Fe(SO4)2。
(2)Fe2+被O2氧化成Fe3+,Fe3+与SCN-作用,溶液呈红色。
(3)分析实验I,两溶液稳定性的差异可能是溶液pH的不同引起的、也可能是NH4+的影响引起的。所以用控制变量法设计对比实验方案。
(4)根据实验现象得出的结论是:溶液pH越小,Fe2+越稳定。用c(H+)浓度对化学平衡:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+的影响解释。
4Fe(OH)3+8H+的影响解释。
(5)实验过程中溶液温度几乎无变化,随着时间的推移c(Fe2+)减小,则反应初期,氧化速率都逐渐增大的可能原因是:生成的Fe(OH)3对反应有催化作用。
(6)根据反应4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+,以及(4)中实验结论,增强Fe2+稳定性的措施有:加入一定量的酸,密封保存。
4Fe(OH)3+8H+,以及(4)中实验结论,增强Fe2+稳定性的措施有:加入一定量的酸,密封保存。
(1)加入KSCN溶液检验Fe3+,出现红色的时间越短,对应物质越不稳定,根据表中时间,FeSO4溶液中先出现红色,溶液的稳定性:FeSO4![]() (NH4)2Fe(SO4)2。
(NH4)2Fe(SO4)2。
(2)FeSO4溶液中加入KSCN溶液后变红的原因:二价铁被氧化,4Fe2+ + O2 + 4H+=4Fe3+ + 2H2O,Fe3+与SCN-生成硫氰化铁溶液变红,Fe3+ + 3SCN-=Fe(SCN)3。
(3)分析实验I,两溶液稳定性的差异可能是溶液pH的不同引起的、也可能是NH4+的影响引起的。所以用控制变量法设计对比实验方案。要证明NH4+对Fe2+的稳定性是否有影响,控制溶液的pH相同和Fe2+浓度相同,设计实验的操作为:取2 mL pH=4.0的0.80 mol·L-1 FeSO4溶液,加2滴0.01 mol·L-1 KSCN溶液,与实验I中(NH4)2Fe(SO4)2溶液现象相同,说明两溶液稳定性的差异不是NH4+引起的。
(4)pH越大,FeSO4溶液变黄的时间越短,即Fe2+越不稳定;根据实验现象得出的结论是:溶液pH越小,Fe2+越稳定。原因是:溶液中存在平衡4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+,pH越小,c(H+)越大,对平衡的抑制作用强,Fe2+更稳定。
4Fe(OH)3+8H+,pH越小,c(H+)越大,对平衡的抑制作用强,Fe2+更稳定。
(5)实验过程中溶液温度几乎无变化,随着时间的推移c(Fe2+)减小,则反应初期,氧化速率都逐渐增大的可能原因是:生成的Fe(OH)3对反应有催化作用。
(6)根据反应4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+,以及(4)中实验结论,增强Fe2+稳定性的措施有:加入一定量的酸(使pH减小),密封保存(隔绝空气)。
4Fe(OH)3+8H+,以及(4)中实验结论,增强Fe2+稳定性的措施有:加入一定量的酸(使pH减小),密封保存(隔绝空气)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
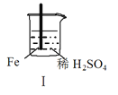
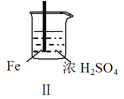
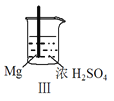
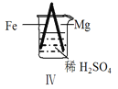
小学生10分钟应用题系列答案【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:

①NiO电极上发生的是_______________反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从_______电极流向______电极(填“NiO”或“Pt”);Pt电极上的电极反应式为_______________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO ![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验_______________(填实验序号)。
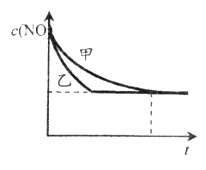
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。