题目内容
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

【答案】 1s22s22p63s23p63d84s2(或Ar[3d84s2] 3 MgO的晶格的比CuO大 Mg原子的3s2全充满,反而比A1原子3p1稳定 1:1 sp、sp3 正四面体 (3/4,3/4,1/4) 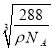
【解析】(1)镍为28号元素,原子核外有28个电子,4s能量低于3d,4s 上排满2个电子后,3d上排8个电子,则原子基态电子排布式为1s22s32p63s23p63d84s2或Ar[3d84s2];s、p、d为三种不同形状的电子云; (2)MgO中的Mg2+半径小于Cu2+,所以MgO的晶格能大于CuO,则MgO的熔点更高;(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是Mg原子的3s2全充满,反而比A1原子3p1稳定;(4) Ni(CO)4中配位键属于σ键, CO中的三键为1个σ键、2个π键,所以σ键个数为1×4+4=8,键个数为2×4=8,所以σ键与π键个数比为1:1;(5)配合物[Cu(CH3C≡N)4]BF4中三键碳原子采用sp杂化,甲基C原子采用sp3杂化, BF4-的空间构型为正四面体;(6)b与周期4个d形成正四面体结构,b 、d与顶点的边线处于晶体对角线上,a (0,0,0)、b (1/2,1/2,1/2),则d的坐标参数为(3/4,3/4,1/4);该晶胞中Cu个数=4,O个数=8×![]() +1=2,Cu和O个数比=4:2=2:1,所以其化学式为Cu2O,该离子化合物的摩尔质量为144g/mol,晶体的密度为ρg/cm3, 阿伏加德罗常数为NA,则晶胞参数a=
+1=2,Cu和O个数比=4:2=2:1,所以其化学式为Cu2O,该离子化合物的摩尔质量为144g/mol,晶体的密度为ρg/cm3, 阿伏加德罗常数为NA,则晶胞参数a=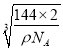 =
=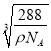 cm。
cm。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案