题目内容
【题目】CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | a |
(1)上述反应的逆反应是(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)2CO(g) K
C(s)+H2O (g)H2(g)+CO(g) K1
CO(g)+H2O (g)H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是 .
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为molL﹣1min﹣1 , 800℃时a= .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(molL﹣1)如表,其中达到平衡状态的是(填字母).
A | B | C | D | |
c(CO2) | 3 | 1 | 0.8 | 1 |
c(H2) | 2 | 1 | 0.8 | 1 |
c(CO) | 1 | 2 | 3 | 0.5 |
c(H2O) | 2 | 2 | 3 | 2 |
【答案】
(1)吸热
(2)K= ![]()
(3)0.15,1,D
【解析】解:(1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,故正反应为放热反应,逆反应为吸热反应;
(2)反应①C(s)+CO2(g)2CO(g)平衡常数K= ![]() ;
;
反应②C(s)+H2O(g)CO(g)+H2(g)平衡常数K1= ![]() ;
;
反应③CO(g)+H2O(g)H2(g)+CO2(g) 平衡常数K2= ![]() ;
;
所以: ![]() =
= ![]() =K;
=K;
![]() (3)①保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%,可知消耗1.2molCO,生成1.2molCO2,
(3)①保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%,可知消耗1.2molCO,生成1.2molCO2,
v= ![]() =0.15molL﹣1min﹣1,
=0.15molL﹣1min﹣1,
CO(g)+ | H2O (g) | H2(g)+ | CO2(g) | |
起始(mol/L) | 1 | 1.5 | 0 | 0. |
转化(mol/L) | 0.6 | 0.6 | 0.6 | 0.6 |
平衡(mol/L) | 0.4 | 0.9 | 0.6 | 0.6 |
K= ![]() =1;
=1;
②如达到平衡,则平衡常数K=1,
A. ![]() =
= ![]() =3>1,没有达到平衡状态,故A错误;
=3>1,没有达到平衡状态,故A错误;
B. ![]() =
= ![]() =
= ![]() 小于1,反应向正反应进行,故B错误;
小于1,反应向正反应进行,故B错误;
C. ![]() =
= ![]() <1,没有达到平衡状态,故C错误;
<1,没有达到平衡状态,故C错误;
D. ![]() =
= ![]() =1,处于平衡状态,故D正确;
=1,处于平衡状态,故D正确;
故答案为:(1)吸热;(2)K=![]() ;(3)0.15;1;D.
;(3)0.15;1;D.
(1)由表格数据“温度升高,平衡常数变小”,结合温度对平衡移动的影响,确定反应的热效应;
(2)根据反应的方程式,确定K、K1、K2的表达式,再根据三个表达式确定三者之间的关系;
(3)①根据公式![]() 、
、![]() 计算;
计算;
②通过计算各个选项中![]() 的值与平衡常数K值的大小,确定反应进行的方向。
的值与平衡常数K值的大小,确定反应进行的方向。

 阅读快车系列答案
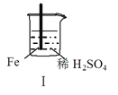
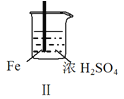
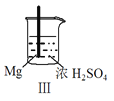
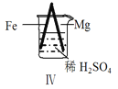
阅读快车系列答案【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强