题目内容
1.反应 3A(g)?2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
分析 (1)反应在10min~20min 内A的浓度变化量=(1.6-1.3)mol/L=0.3mol/L,v(A)=$\frac{0.3mol/L}{10min}$=0.03mol/L,同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,据此计算D的反应速率;
(2)1、2反应达到平衡状态时A物质的物质的量浓度不变,但10min时A物质的物质的量浓度不同,说明实验2的目的是探究催化剂对化学反应速率的影响,所以1、2中A的初始浓度相同;反应达到平衡状态时各物质的物质的量浓度不变;
(3)相同温度、相同体积时,物质的量浓度越大反应速率越大;实验1中,达到平衡状态时A物质浓度变化量=(2.0-0.8)mol/L=1.2mol/L,c(B)=$\frac{2}{3}×1.2mol/L$=0.8mol/L,
c(D)=$\frac{1}{3}×1.2mol/L$=0.4mol/L,平衡常数K=$\frac{(0.8)^{2}×0.4}{(0.8)^{3}}$=0.5;
温度不变,化学平衡常数不变,实验3中A物质浓度变化量=(c3-1.0)mol/L,c(B)=$\frac{2}{3}×({c}_{3}-1.0)$mol/L,
c(D)=$\frac{1}{3}×({c}_{3}-1.0)$mol/L,化学平衡常数K=$\frac{[\frac{2}{3}×({c}_{3}-1.0)]^{2}.[\frac{1}{3}×({c}_{3}-1.0)]}{1.{0}^{3}}$=0.5;
(4)升高温度,平衡向吸热反应方向移动.
解答 解:(1)反应在10min~20min 内A的浓度变化量=(1.6-1.3)mol/L=0.3mol/L,v(A)=$\frac{0.3mol/L}{10min}$=0.03mol/(L.min),同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,所以v(D)=$\frac{1}{3}$v(A)=$\frac{1}{3}$×0.03mol/(L.min)=0.01mol/(L.min),
故答案为:0.01;
(2)1、2反应达到平衡状态时A物质的物质的量浓度不变,但10min时A物质的物质的量浓度不同,说明实验2的目的是探究催化剂对化学反应速率的影响,所以1、2中A的初始浓度相同,则c2=2.0mol/L;反应达到平衡状态时各物质的物质的量浓度不变,20min时A的物质的量浓度不变,所以20min时该反应达到平衡状态,
故答案为:2.0;20;加入了正催化剂;
(3)相同温度、相同体积时,物质的量浓度越大反应速率越大,所以v3>v1;
实验1中,达到平衡状态时A物质浓度变化量=(2.0-0.8)mol/L=1.2mol/L,c(B)=$\frac{2}{3}×1.2mol/L$=0.8mol/L,
c(D)=$\frac{1}{3}×1.2mol/L$=0.4mol/L,平衡常数K=$\frac{(0.8)^{2}×0.4}{(0.8)^{3}}$=0.5;
温度不变,化学平衡常数不变,实验3中A物质浓度变化量=(c3-1.0)mol/L,c(B)=$\frac{2}{3}×({c}_{3}-1.0)$mol/L,
c(D)=$\frac{1}{3}×({c}_{3}-1.0)$mol/L,化学平衡常数K=$\frac{[\frac{2}{3}×({c}_{3}-1.0)]^{2}.[\frac{1}{3}×({c}_{3}-1.0)]}{1.{0}^{3}}$=0.5,
c3=2.5,
故答案为:>;2.5;
(4)从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应,
故答案为:放热;从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
点评 本题考查探究化学反应速率影响因素及化学平衡有关计算,侧重考查学生分析判断及总结归纳能力,正确分析表中数据及推断改变条件是解本题关键,难点是(3)中c3的计算,题目难度中等,注意:温度不变平衡常数不变.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
| A. | 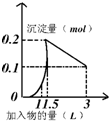 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. | 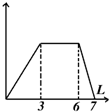 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. |  向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
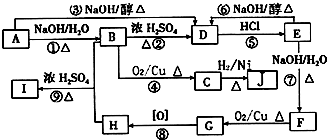
 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基. .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式 .
.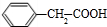 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$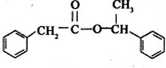 +H2O
+H2O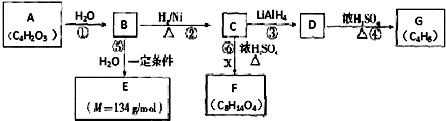
 .
. .
.
 E的元素符号是Cl.
E的元素符号是Cl.