题目内容
9.下列各组离子在指定溶液中能大量共存的是( )①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-.
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
分析 ①无色溶液中不含有色离子,且离子之间不反应的能大量共存;
②pH=11的溶液呈碱性;
③加入Al能放出H2的溶液为强碱溶液或非强氧化性酸溶液;
④由水电离出的c(OH-)=10-13mol•L-1的溶液呈酸性或碱性;
⑤有较多Fe3+的溶液不能大量存在和铁离子反应的离子;
⑥酸性溶液中不能大量存在相互反应的离子.
解答 解:①无色溶液中不存在有色离子,如铜离子,且Cu2+、OH-反应生成沉淀而不能大量共存,故错误;
②pH=11的溶液呈碱性,这几种离子之间不反应,所以能大量共存,故正确;
③加入Al能放出H2的溶液为强碱溶液或非强氧化性酸溶液,酸性或碱性条件下都不能大量存在HCO3-,碱性条件下不能大量存在NH4+,故错误;
④由水电离出的c(OH-)=10-13mol•L-1的溶液呈强酸性或强碱性,这几种离子之间不反应且和氢离子或氢氧根离子都不反应,所以能大量共存,故正确;
⑤有较多Fe3+的溶液,Fe3+、SCN-发生络合反应而不能大量共存,且铁离子和碳酸氢根离子相互促进水解,故错误;
⑥酸性溶液中:Fe2+、I-和NO3-发生氧化还原反应而不能大量共存,故错误;
故选C.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应、氧化还原反应、络合反应,明确离子性质及离子共存条件是解本题关键,注意隐含条件的挖掘,题目难度中等.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
4.一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml.原合金中钠的质量为( )
| A. | 0.92g | B. | 0.69g | C. | 0.64g | D. | 0.23g |
14.摩尔质量最大的化合物是( )
| A. | NO2 | B. | NaOH | C. | Cl2 | D. | HCl |
1.反应 3A(g)?2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
| 实验 序号 | 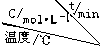 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
18. 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
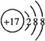 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为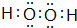 .
.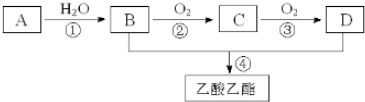
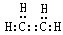 .
. ,取代反应.
,取代反应.