题目内容
6.如图曲线图(纵坐标为沉淀的量,横坐标为加入物的量)不正确的是( )| A. | 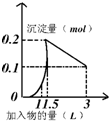 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. | 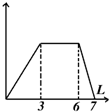 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. | 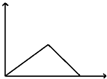 向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
分析 A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,然后是硫酸和NaAlO2发生反应的过程;
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程;
C、向氢氧化钠中加明矾,开始阶段碱过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程;
D、向AlCl3溶液滴加过量氨水,开始会出现氢氧化铝的白色沉淀,氢氧化铝不溶于过量氨水.
解答 解:A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,所以反应开始就有沉淀生成,然后是硫酸和NaAlO2发生反应的过程,当加入2.5L硫酸,沉淀氢氧化铝全部溶解,故A错误;
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程,消耗NaOH的量之比是3:3:1,故B正确;
C、向氢氧化钠中加明矾,开始阶段碱过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程,故C正确;
D、向AlCl3溶液滴加过量氨水,开始会出现氢氧化铝的白色沉淀,氢氧化铝不溶于过量氨水,故D错误.
故选AD.
点评 本题考查学生物质的性质以及化学反应发生的先后知识,结合图象来考查,增加了题目的难度.

练习册系列答案
相关题目
14.摩尔质量最大的化合物是( )
| A. | NO2 | B. | NaOH | C. | Cl2 | D. | HCl |
1.反应 3A(g)?2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
18.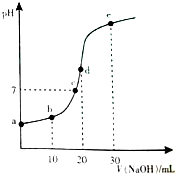 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
15.取某铁的氧化物样品,用140mL 5mol/L盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中的Fe2+ 完全转化为 Fe3+,该样品中可能的化学式是( )
| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O6 | D. | Fe5O7 |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
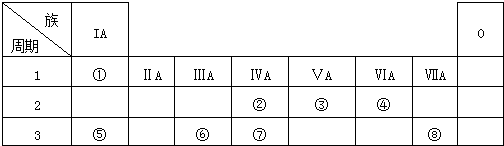
 .
.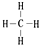 ,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).
,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示). ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.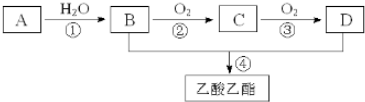
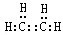 .
.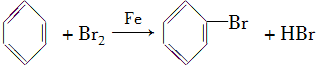 ,取代反应.
,取代反应.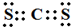 .
.