题目内容
11.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是最强的含氧酸之一.(1)B在周期表中的位置是第二周期ⅦA族,甲的电子式是
 E的元素符号是Cl.
E的元素符号是Cl.(2)单质D与C的最高价氧化物对应水化物的水溶液反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)单质E是一种有毒气体,在实验室中多余的E通常用C的最高价氧化物对应水化物的水溶液吸收,则该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,C、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则形成的离子化合物甲为Na2O、乙为Na2O2,A是O元素,C是Na元素,B是最活泼的非金属元素,则B是F元素,D是地壳中含量最高的金属元素,则D是Al元素,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素,结合元素化合物的性质解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,C、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则形成的离子化合物甲为Na2O、乙为Na2O2,A是O元素,C是Na元素,B是最活泼的非金属元素,则B是F元素,D是地壳中含量最高的金属元素,则D是Al元素,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素,
(1)B为氟元素,位于周期表中第二周期ⅦA族,甲为Na2O,电子式为 ,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素,
,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素,
故答案为:第二周期ⅦA族; ;Cl;
;Cl;
(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了位置结构性质的关系,正确推断元素是解本题关键,侧重对化学用语的考查难度不大.

练习册系列答案
相关题目
1.反应 3A(g)?2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
| 实验 序号 | 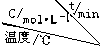 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
3.下列说法不正确的是( )
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
10. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式N2+3H2$?_{高温高压}^{催化剂}$2NH3.
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
 .
. .
. .
. 既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为
既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为 .
.