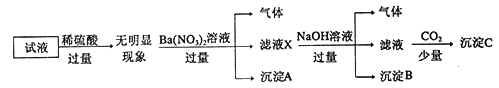
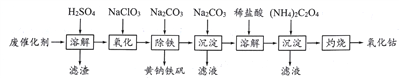
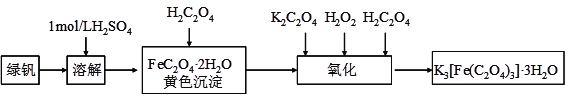题目内容
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
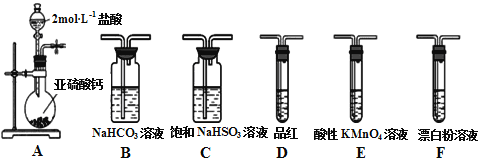
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
【答案】 CaSO3+2H+=Ca2++SO2↑+H2O 二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理 B→E→D→F 装置D中品红溶液不褪色,F中出现白色沉淀 品红溶液 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 3000a/107V
【解析】试题分析:(1)装置A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水;(2)二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理;根据强酸制取弱酸,探究亚硫酸与次氯酸的酸性强弱,需要把二氧化硫中含有的杂质氯化氢除去,再把二氧化硫通入碳酸氢钠溶液中制取二氧化碳,通过品红溶液验证无二氧化硫,最后把二氧化碳通入漂白粉溶液中生成碳酸钙沉淀,从而证明酸性亚硫酸>碳酸>次氯酸;(3)①根据二氧化硫可以使品红褪色,B中试剂是品红溶液;②装置A中Na2S、Na2CO3、SO2发生反应生成Na2S2O3、CO2;
③根据IO3-+5I-+6H+=3I2+3H2O,2S2O32-+I2=S4O62-+2I-,可得关系式IO3-~~6S2O32-,根据关系式计算。
解析:(1)装置A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水,反应方程式是CaSO3+2H+=Ca2++SO2↑+H2O;(2)二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理;根据强酸制取弱酸,探究亚硫酸与次氯酸的酸性强弱,需要把二氧化硫中含有的杂质氯化氢除去,再把二氧化硫通入碳酸氢钠溶液中制取二氧化碳,通过品红溶液验证无二氧化硫,最后把二氧化碳通入漂白粉溶液中生成碳酸钙沉淀,从而证明酸性亚硫酸>碳酸>次氯酸,所以正确的连接顺序是:A→C→B→E→D→F,现象是装置D中品红溶液不褪色,F中出现白色沉淀;(3)①根据二氧化硫可以使品红褪色,B中试剂是品红溶液;②装置A中Na2S、Na2CO3、SO2发生反应生成Na2S2O3、CO2,反应方程式是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
③根据IO3-+5I-+6H+=3I2+3H2O,2S2O32-+I2=S4O62-+2I-,可得关系式IO3-~~6S2O32-;设c(Na2S2O3)=cmol/L
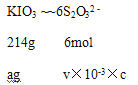
c(Na2S2O3)= 3000a/107V

 阅读快车系列答案
阅读快车系列答案【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0
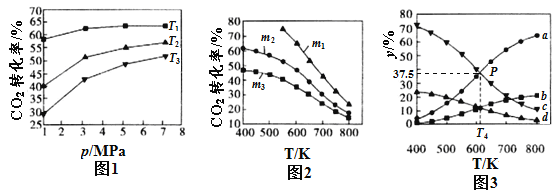
①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
【题目】水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
【提出问题】过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】
①可能有一种气体和另一种物质生成.
②反应过程中可能有能量变化.
【设计实验】如图所示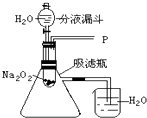
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中的分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是 . 发生的反应方程式为其中氧化剂为;还原剂为;产生0.2mol的氧气,需要的转移电子mol.
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因: .
(3)实验二:继续探究反应后生成的另一种物质是什么?
小强猜想另一种物质是Na2CO3 , 小明认为不可能,小明的依据是 .
(4)为了证实小明的看法,请你设计一个证明CO32﹣不存在的实验.
实验步骤 | 实验现象 | 实验结论 |
(5)小明取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的另一种物质是(填化学式).