题目内容
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)能溶于水,难溶于乙醇,该配合物对光敏感,光照下即发生分解。可用如下流程来制备。根据题意完成下列各题:
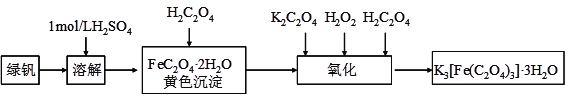
(1)溶解时加稀硫酸的作用是__________________________
(2)向溶解液加入一定量的草酸后,加热煮沸,形成黄色沉淀,过滤,洗涤。
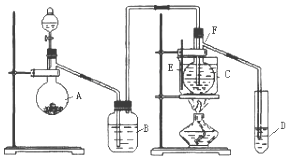
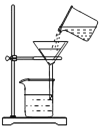
①如右图是过滤装置图请指出图中两处明显错误,一处是_____________________,另一处是漏斗的下尖端没有紧靠接受的烧杯。
②如何确定沉淀已经洗涤干净____________________________________。
(3)氧化过程中除不断搅拌外,维持温度在40℃左右,原因是___________________________。
(4)写出氧化生成三草酸合铁(Ⅲ)酸钾的离子方程式__________________________________。
(5)三草酸合铁(Ⅲ)酸钾晶体光照下即可分解生成两种草酸盐、CO2等。写出该分解反应的化学方程式______________________。
【答案】 抑制Fe2+的水解 未使用玻璃棒引流 取最后的洗涤液,向其中滴加盐酸酸化的氯化钡溶液,不产生白色沉淀,则已洗涤干净 温度太低反应速率慢,温度高过氧化氢会分解 2FeC2O4·2H2O+H2O2+H2C2O4+3C2O42-=2[Fe(C2O4)3]3-+6H2O 2K3[Fe(C2O4)3]·3H2O![]() 3K2C2O4+2FeC2O4+2CO2↑+6H2O
3K2C2O4+2FeC2O4+2CO2↑+6H2O
【解析】试题分析:(1)硫酸亚铁易水解呈酸性,加入硫酸可以防止水解;(2)①过滤需要用玻璃棒引流;②晶体洗涤干净后,洗涤液中不含SO42-,可以根据洗涤液中是否含有SO42-判断是否洗涤干净;(3)温度太低反应速率慢,温度高过氧化氢会分解;(4)氧化过程FeC2O4·2H2O、H2O2、H2C2O4、K2C2O4生成三草酸合铁(Ⅲ)酸钾;(5)三草酸合铁(Ⅲ)酸钾晶体光照下即可分解生成CO2,根据氧化还原反应规律,生成的草酸盐是K2C2O4、FeC2O4;
解析:(1)硫酸亚铁易水解呈酸性,加入硫酸抑制Fe2+的水解;(2)①过滤需要用玻璃棒引流,所以明显错误是未使用玻璃棒引流;②确定沉淀已经洗涤干净的方法是:取最后的洗涤液,向其中滴加盐酸酸化的氯化钡溶液,不产生白色沉淀,则已洗涤干净;(3)温度太低反应速率慢,温度高过氧化氢会分解,所以维持温度在40℃左右;(4)氧化过程FeC2O4·2H2O、H2O2、H2C2O4、K2C2O4生成三草酸合铁(Ⅲ)酸钾,反应方程式是2FeC2O4·2H2O+H2O2+H2C2O4+3C2O42-=2[Fe(C2O4)3]3-+6H2O;(5)三草酸合铁(Ⅲ)酸钾晶体光照下即可分解生成CO2,根据氧化还原反应规律,生成的草酸盐是K2C2O4、FeC2O4,该分解反应的化学方程式是2K3[Fe(C2O4)3]·3H2O![]() 3K2C2O4+2FeC2O4+2CO2↑+6H2O;
3K2C2O4+2FeC2O4+2CO2↑+6H2O;

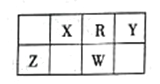
【题目】根据下表中的信息分析回答问题:
元素 | 元素或由元素组成的物质性质 |
A | 单质在自然界中硬度最大,燃烧产生的气体能使澄清石灰水变浑浊。 |
B | 原子最外层电子数是次外层电子数三倍 |
C | 金属焰色反应为黄色,与氧气燃烧生成淡黄色固体 |
D | 单质在空气中体积分数最大 |
E | 固体为淡黄色,燃烧产生气体有漂白性。 |
F | 相同条件下气体密度最小 |
(1)用电子式写出形成F2E的过程__________________;
(2)写出CBF物质的电子式______________;
(3)C2B2物质中存在化学键的类型是___________ ,1 molC2B2与足量AB2反应转移的电子数为_______;
(4)由B、C、E形成的简单离子半径由大到小的关系是______________(用离子符号表示)。