��Ŀ����
����Ŀ��ˮ�����Ҳ�������𣮰������������ƣ�Na2O2����ĩ�ø�����֬�ް�������֬�������Ʋ���Ӧ����������ˮ�ε����й������Ƶ���֬���ϣ�����֬��Ѹ�ٷ���ȼ�գ�С���Դ�����ܸ���Ȥ����������ͬѧ�ǽ�������̽����
��������⡿����������ˮ��Ӧ������ʲô���ʣ�Ϊʲô��֬��ȼ�գ�
�����롿
�ٿ�����һ���������һ���������ɣ�
�ڷ�Ӧ�����п����������仯��
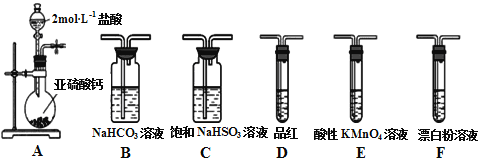
�����ʵ�顿��ͼ��ʾ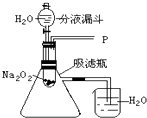
ʵ��һ��̽����Ӧ�����ɵ�������ʲô��
��1������ͼװ���еķ�Һ©���Ļ��������Ƶμ�ˮ���ٶȣ��۲쵽�Թ��������ݲ������ô����ǵ�ľ������P����ľ����ȼ��˵�����ɵ������� �� �����ķ�Ӧ����ʽΪ����������Ϊ����ԭ��Ϊ������0.2mol����������Ҫ��ת�Ƶ���mol��
��2��ʵ���У����۲쵽�����ձ��еĵ��ܿ�������ð��������Ͳ����������ԭ�� ��
��3��ʵ���������̽����Ӧ�����ɵ���һ��������ʲô��
Сǿ������һ��������Na2CO3 �� С����Ϊ�����ܣ�С���������� ��
��4��Ϊ��֤ʵС���Ŀ������������һ��֤��CO32�������ڵ�ʵ�飮
ʵ�鲽�� | ʵ������ | ʵ����� |
��5��С��ȡ��Ӧ�����õ���Һ���Թ��У�������ɫ��̪��Һ�����ַ�̪��Һ���ɫ��˵����Ӧ�����õ���һ�����������ѧʽ����
���𰸡�
��1��O2������������2Na2O2+2H2O=4NaOH+O2����Na2O2��Na2O2��0.4
��2����Ӧ�������������ų���ʹ����ƿ�ڿ�����������
��3�����������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣬����Ӧ���в���̼Ԫ��
��4��ȡ������Ӧ��������Һ���Թ��У�����ϡ���û�����ݲ�����������CO32��
��5��NaOH
���������⣺ʵ��һ��
��1.������������ȼ�ԣ���ʹ�����ǵ�ľ����ȼ��˵�����ɵ������������������ķ�Ӧ�ǹ������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ2Na2O2+2H2O=4NaOH+O2������Ӧ�� ��Ԫ�ػ��ϼ۩�1�۱仯Ϊ��2�ۺ�0�ۣ������������������ͻ�ԭ������ѧ����ʽ��������1mol��������ת��2mol������0.2mol����������Ҫ��ת�Ƶ���0.4mol���Դ��ǣ�O2������������2Na2O2+2H2O=4NaOH+O2����Na2O2��Na2O2��0.4��
��2.���Թ��ڷ����ķ�Ӧ�ų�������ʹ����ƿ�ڵ��¶����ߣ�����ѹǿ�������Իῴ�����ܿ�������ð�������Դ��ǣ���Ӧ�������������ų���ʹ����ƿ�ڿ����������ͣ�ʵ�����
��3.�����������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣬��Ӧ����û��̼Ԫ�أ������������Ҳ��������̼Ԫ�أ�̼���������������ᷴӦ���ɶ�����̼��������ð������û������ð������˵��û��̼������ӣ����Դ��ǣ����������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣬����Ӧ���в���̼Ԫ��.
��4.��
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Ӧ��������Һ���Թ��У�����ϡ���� | û�����ݲ��� | ������CO32�� |
��5.����̪��Һ���˵����Һ�Լ��ԣ�һ�������������ӣ�����һ���������������Ӻͽ������ӹ��ɵģ���Ӧ���еĽ���Ԫ��ֻ����Ԫ�أ����Ը��������������ƣ����Դ��ǣ�NaOH��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�