题目内容
12.下列有关说法正确的是( )| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁铁做负极被腐蚀;
C.依据纯水是呈中性的,一定温度下水中的氢离子浓度和氢氧根离子浓度乘积是常数,温度升高促进水的电离,水的离子积增大分析;
D.加热促进弱酸的电离.
解答 解:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,反应△S>0,△H-T△S>0,说明该反应的△H>0,故A错误;
B、镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁形成原电池,铁做负极被腐蚀,故B错误;
C.水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,生成的氢离子和氢氧根离子浓度增大,pH减小,水的离子积增大,水的离子积只随温度的改变而改变,但电离出的氢离子和氢氧根离子相等,所以水仍是中性.综上所述,给纯水加热时水的离子积增大、pH减小、呈中性,故C错误;
D.向0.1mol•L-1CH3COOH溶液加热,促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,则c(H+)与c(CH3COOH)的比值增大,故D正确.
故选D.
点评 本题考查了自发进行的判断依据、原电池原理的应用、水的电离、弱酸的电离等,题目难度中等,侧重于有关原理的考查;

练习册系列答案
相关题目
2.下列叙述中不正确的是( )
| A. | 油脂属于酯类 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 煤的干馏产物中含有芳香烃 | |
| D. | 质量相等的乙烯和丙烯完全燃烧消耗的氧气的物质的量相同 |
3.用1mol•L-1的盐酸与锌反应来制取H2,为了加快反应速率,可采取的措施是( )
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
7.下表所列的是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)B元素位于周期表中第三周期ⅢA族.
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)B、E形成的化合物为Al2O3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)B、E形成的化合物为Al2O3(填化学式).
1.在无色溶液中下列粒子能大量共存的是( )
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
2.下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
 Na2O2
Na2O2
 →
→ 、MgCl2
、MgCl2 .
.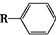 $→_{一定条件}^{CO,HCl}$
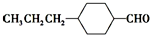
$→_{一定条件}^{CO,HCl}$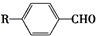 ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: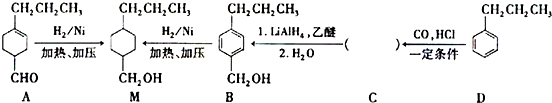
 和
和 (写结构简式)生成.
(写结构简式)生成.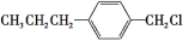 .
.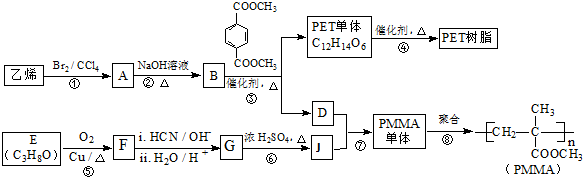 已知:
已知: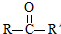 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$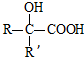 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. .
.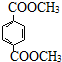 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH