题目内容
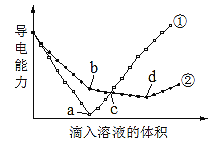
【题目】如图所示是某化学兴趣小组根据教材知识设计的证明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
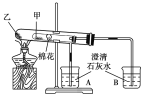
A. 甲为NaHCO3,乙为Na2CO3
B. 要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯中的澄清石灰水变浑浊
D. 整个实验过程中A烧杯中的澄清石灰水不会变浑浊
【答案】C
【解析】
A.碳酸氢钠不稳定,受热易分解,碳酸钠受热不分解,结合图中装置可知,乙受热温度高,应该为碳酸钠;B.白色的无水硫酸铜与水反应生成蓝色的硫酸铜晶体,据此可以检验是否有水生成;C.碳酸钠不分解,则A烧杯中不会出现浑浊现象,应该是B烧杯中的澄清石灰水出现浑浊现象;D.由于碳酸钠稳定性较强,加热过程中不分解,则整个过程中A烧杯中的澄清石灰水不会变浑浊.
A、由图可知,实验时大试管内的温度高于小试管内的温度,为了证明Na2CO3的热稳定性大于NaHCO3的热稳定性,该套管实验中乙为Na2CO3,甲为NaHCO3,故A正确。B、无水硫酸铜遇水变蓝,故B正确。C、实验过程中NaHCO3受热分解产生CO2,B烧杯中澄清石灰水变浑浊;Na2CO3受热不分解,无CO2气体产生,所以A烧杯中澄清石灰水不会变浑浊,故C错误,D、由于碳酸钠不分解,则整个过程中烧杯A中的澄清石灰水不会变浑浊,D正确;故选C。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。