题目内容
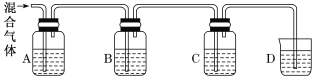
【题目】如图是实验室制备气体和验证气体性质的装置图。
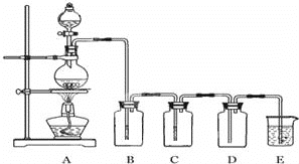
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
【答案】验证SO2是否除净 D装置中品红不褪色,E装置中溶液变浑浊 有黄色沉淀 Na2SiO3 SiO32-+H2O+CO2=H2SiO3↓+CO32-
【解析】
①该装置为碳和浓硫酸的反应装置,那么A为发生装置,发生的反应为C+2H2SO4![]() CO2↑+2SO2↑+2H2O;B装置中盛放品红,产物通入品红过后品红褪色,证明碳和浓硫酸反应的产物中含有SO2,将气体通入盛放酸性KMnO4溶液的洗气瓶,酸性KMnO4溶液褪色,将SO2吸收,再将产物通入品红溶液中,检验SO2是否被完全吸收,若完全吸收,将剩余物质通入澄清石灰水中,验证产物CO2的存在,据此回答问题。
CO2↑+2SO2↑+2H2O;B装置中盛放品红,产物通入品红过后品红褪色,证明碳和浓硫酸反应的产物中含有SO2,将气体通入盛放酸性KMnO4溶液的洗气瓶,酸性KMnO4溶液褪色,将SO2吸收,再将产物通入品红溶液中,检验SO2是否被完全吸收,若完全吸收,将剩余物质通入澄清石灰水中,验证产物CO2的存在,据此回答问题。
②将碳和浓硫酸反应的产物通入Na2S溶液,SO2与Na2S反应,生成不溶于水的S单质,将产物通入足量酸性KMnO4溶液可将SO2吸收,用品红验证SO2是否被完全吸收,将CO2通入硅酸钠溶液中,利用强酸制弱酸原理,验证碳酸的酸性强于硅酸。
①D装置中品红溶液用于验证SO2是否被完全吸收;当D中品红溶液不褪色,E中澄清石灰水变浑浊说明反应中有CO2生成;
②将碳和浓硫酸反应的产物通入Na2S溶液,SO2与Na2S反应,生成不溶于水的S单质,因此B中能看到有淡黄色沉淀生成,F中加入Na2SiO3溶液,若将CO2通入Na2SiO3溶液中,看到有白色胶状沉淀生成,说明生成了硅酸,利用强酸制弱酸原理可知碳酸的酸性强于硅酸,发生的离子反应为:SiO32-+H2O+CO2=H2SiO3↓+CO32-。
流程设计 |
| |||
实验装置 |
| |||
所选试剂 | 品红溶液 | 酸性KMnO4溶液 | 品红溶液 | 澄清石灰水 |
预期现象 | 褪色 | 褪色 | 不褪色 | 变浑浊 |
注意事项:有时为了简化装置,可将除去SO2和检验SO2是否除尽合并为一个装置,并使用较浓的酸性KMnO4溶液,现象为酸性KMnO4溶液的颜色变浅。 | ||||

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2