题目内容
【题目】已知电解质溶液的导电能力与离子浓度和离子所带电荷数均呈正相关。在两份等物质的量浓度且等体积的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
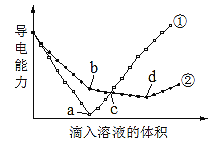
A.①代表滴加NaHSO4溶液的变化曲线
B.反应到b点时,过滤,向滤液中滴加溶液,发生反应的离子方程式为![]()
C.c点两溶液导电能力相同,所以两溶液中含有等物质的量浓度的OH—
D.a点对应的溶液显中性,d点对应的溶液显酸性
【答案】B
【解析】
A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,故A错误;
B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH,b点溶液中加入硫酸氢钠溶液时,实际上是酸碱中和反应,离子方程式为H++OH═H2O,故B正确;
C.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,故C错误;
D.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水,溶液呈中性;d点②中溶质为Na2SO4,溶液也呈中性,故D错误;
故选B。

 应用题作业本系列答案
应用题作业本系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
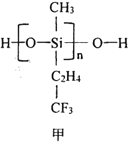
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
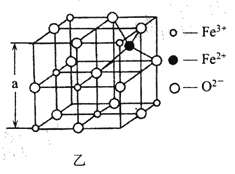
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)