题目内容
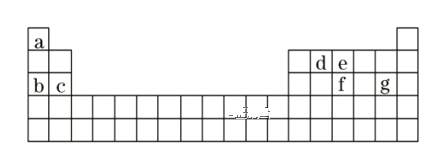
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
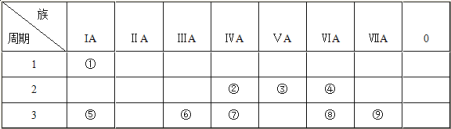
(1)④、⑤、⑧三种元素中,离子半径由大到小的顺序为____(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ (填化学式)。⑧和⑨元素的气态氢化物稳定性顺序为__________。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____。
(4)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式________。
(5)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_________。
(6)能说明⑧的非金属性比⑨的非金属性______(填“强”或“弱”)的事实是__________(用离子方程式说明)。
(7)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式____。
【答案】S2->O2->Na+ H2SO4>H2CO3>H2SiO3 HCl>H2S 2Al+2OH-+2H2O=2AlO2-+3H2↑ ![]() 2Na2O2 +2CO2 =2Na2CO3 +O2 弱 Cl2+S2-=S↓+2Cl-
2Na2O2 +2CO2 =2Na2CO3 +O2 弱 Cl2+S2-=S↓+2Cl- ![]()
【解析】
由元素在周期表中的相对位置可知,①为H元素、②为C元素、③为N元素、④为O元素、⑤为Na元素、⑥为Al元素、⑦为Si元素、⑧为S元素、⑨为Cl元素。
(1)④、⑤形成的离子为电子层结构相同的O2-和Na+,⑧形成的离子为S2—,电子层结构相同的核电荷数越大离子半径越小,离子半径O2->Na+,同主族的离子从上到下,离子半径依次增大,离子半径S2—>O2-,则离子半径由大到小的顺序为S2->O2->Na+,故答案为:S2->O2->Na+;
(2)元素非金属性越强,最高价含氧酸的酸性越强,非金属性S>C>Si,故酸性H2SO4>H2CO3>H2SiO3;元素非金属性越强,氢化物越稳定,非金属性Cl>S,故氢化物的稳定性HCl>H2S,故答案为:H2SO4>H2CO3>H2SiO3;HCl>H2S;
(3)⑥为铝,⑤的最高价氧化物的水化物氢氧化钠,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)H、O、Na、Cl四种元素间可形成既含离子键又含极性共价键的离子化合物为NaOH和NaClO,NaOH的电子式为![]() ,次氯酸钠的电子式为
,次氯酸钠的电子式为![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(5)O元素和Na元素形成原子个数比为1:1的化合物为淡黄色的过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2 +2CO2 =2Na2CO3 +O2,故答案为:2Na2O2 +2CO2 =2Na2CO3 +O2;
(6)氯气能从氢硫酸或硫化钠溶液中置换出硫,说明硫元素的非金属性弱于氯元素,反应的离子方程式为Cl2+H2S=S↓+2Cl-+2H+或Cl2+S2-=S↓+2Cl-,故答案为:Cl2+H2S=S↓+2Cl-+2H+或Cl2+S2-=S↓+2Cl-;
(7)氢元素和氮元素可以形成18电子的化合物N2H4,N2H4是共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
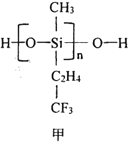
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
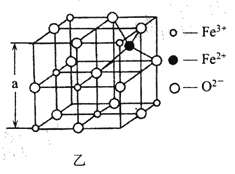
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2