题目内容
12.氨的合成是最重要的化工生产之一.Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
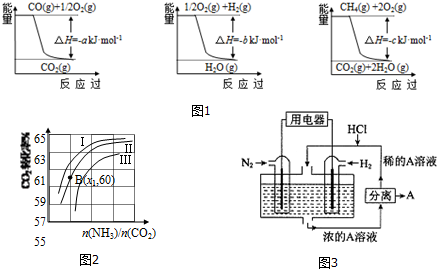
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
分析 Ⅰ.由图1可知热化学方程式分别为:
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-bkJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-ckJ•mol-1,然后根据盖斯定律来解答;
Ⅱ.(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
(2)甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,应用等效平衡的知识来分析比较c1的c2相对大小;
(3)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ;
②根据氨气和二氧化碳的转化率之比求出x1;
Ⅲ.电池正极发生还原反应,A是生成的氯化铵.
解答 解:Ⅰ.由图1可知热化学方程式分别为:
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-bkJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-ckJ•mol-1
由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+(a+3b-c)kJ•mol-1,
故答案为:+(a+3b-c)kJ•mol-1;
Ⅱ.(1)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N2)正=v(H2)逆时,才说明达到平衡状态,氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)若为恒压容器,甲乙容器中达到平衡所用时间相同,为5min,但是容器恒容,甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,即t>5min,甲相当于在丙平衡的基础上,再充入1mol的氮气,根据平衡移动的原理,增加一种反应物平衡向减弱这种方向移动,但不抵消,所以甲氮的浓度大于丙,故答案为:>;>;
(3)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
②由题意可知:2NH3(g)+CO2(g)?CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:$\frac{2a}{{x}_{1}}$=$\frac{a}{1}$,$\frac{{x}_{1}}{2a}$=30%,$\frac{1}{a}$=60%,则x1=4,
故答案为:4;
Ⅲ.电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,故答案为:N2+8H++6e-=2NH4+;氯化铵.
点评 本题考查较为综合,涉及化学反应与能量、化学平衡状态的判断等,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意利用三段式法计算,较为直观,难度不大.

 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
| A. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| D. | 24g3H218O含有的中子数为10NA |
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |
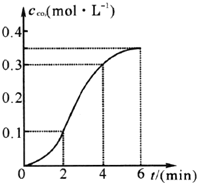 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.