题目内容
7. 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为1s22s22p63s23p63d9.已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态.
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为4NA.类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N )的沸点低于异硫氰酸(H-N=C=S)的沸点.其原因是异硫氰酸分子间可形成氢键,而硫氰酸不能.
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子的杂化方式为sp3,B与N之间形成配位键,氮原子提供孤电子对.
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力.
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是$\frac{4×25}{(361.5×1{0}^{-10})^{3}{N}_{A}}$ g/cm3.(只要求列算式).
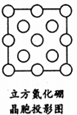
(5)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置.
分析 (1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键;
能形成分子间氢键的物质熔沸点较高;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式,B与N之间形成配位键,氮取子提供孤电子对;
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;
(5)如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;
能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式为sp3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,
故答案为:sp3;孤电子对;
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{25}{{N}_{A}}×4}{(365.1×1{0}^{-10})^{3}}$g/cm3=$\frac{4×25}{(361.5×1{0}^{-10})^{3}{N}_{A}}$g/cm3,
故答案为:分子间作用力;$\frac{4×25}{(361.5×1{0}^{-10})^{3}{N}_{A}}$;
(5)如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以其图为 ,故答案为:
,故答案为: .
.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力及计算能力,涉及晶胞计算、原子杂化方式判断、配位键及氢键、原子核外电子排布等知识点,难点是晶胞计算及(5)题,采用三视图确定N原子和B原子位置关系,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 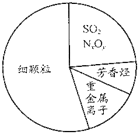 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
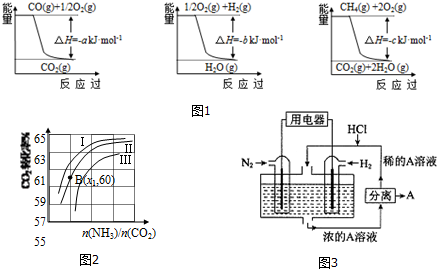
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
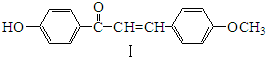

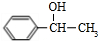 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为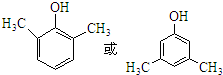 (任写一种).
(任写一种).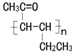 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,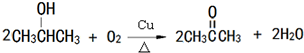 ,
, .
.