题目内容
2.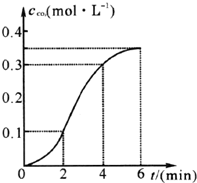 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
分析 CaCO3与稀盐酸的反应为放热反应,随着反应的进行,温度逐渐升高,盐酸浓度逐渐降低,结合各时间段二氧化碳物质的量的变化可比较反应速率的大小,以此解答该题;
A、相同时间内,生成的二氧化碳的体积越大,表明反应速率越快,据此结合图象判断;
B、4min后氢离子浓度起主要作用,氢离子浓度降低;
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,2~4min反应速率最快,说明反应为放热反应,0~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用;
D、反应速率V=$\frac{△c}{△t}$计算判断.
解答 解:A.由图象可知,0~2分钟时间内,生成二氧化碳0.1mol,2~4分钟时间内,生成二氧化碳0.2mol,4~6分钟时间内,生成二氧化碳0.1mol,则反应刚开始时反应速率较小,然后逐渐增大,最后减小,故A错误;
B.由图象可知,反应4分钟后曲线斜率变小,则反应速率减小,故B正确;
C.随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,0~2分钟反应刚开始,温度较低此时反应速率由氢离子浓度决定,2~4min反应速率最快,2~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用,故C正确;
D、图象分析可知,反应在第2分钟初至第4分钟末生成CO2的平均反应速率=$\frac{0.3mol/L-0.1mol/L}{4min-2min}$=0.1 mol/(L•min),所以反应在第2分钟初至第3分钟末生成CO2的平均反应速率不是0.1 mol/(L•min),故D错误;
故选AD.
点评 本题考查反应速率的定量表示及有关图象,为高频考点,侧重于学生的分析能力的考查,难度中等,注意根据速率定义式进行理解,注意理解影响反应速率的因素.

Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
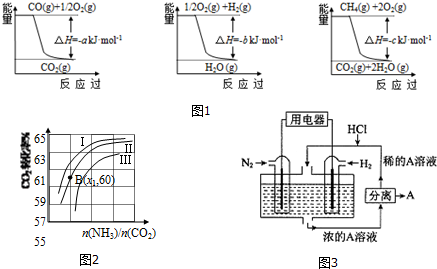
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
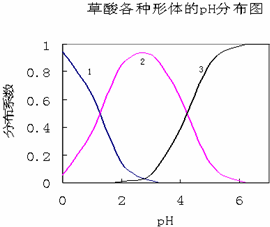 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: