题目内容
在2A+B 3C+4D反应中,表示该反应速率最快的是( )。
3C+4D反应中,表示该反应速率最快的是( )。
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
 3C+4D反应中,表示该反应速率最快的是( )。
3C+4D反应中,表示该反应速率最快的是( )。A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
B
正确的思路应是根据反应速率与化学方程式中化学计量数之间的关系将各物质的反应速率转化为用同一种物质表示的速率。A项中据v(A)推知v(B)=0.25 mol·L-1·s-1,C项中据v(C)推出v(B)=0.27 mol·L-1·s-1,D项中据v(D)推出v(B)=0.25 mol·L-1·s-1,故反应速率最快的是B选项。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
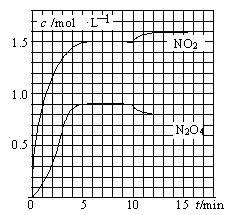
 2NO2(g)
2NO2(g) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: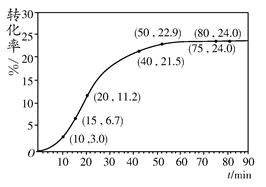


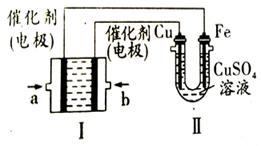
 pZ(g)+qQ(g)
pZ(g)+qQ(g)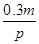 mol/(L·s),则2秒钟内Q物质增加了( )
mol/(L·s),则2秒钟内Q物质增加了( )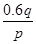 mol
mol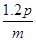 mol
mol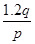 mol
mol PCl5(g),5 min末达到平衡,有关数据如表。
PCl5(g),5 min末达到平衡,有关数据如表。 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: