题目内容
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
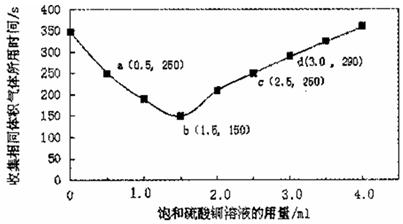

| A.饱和硫酸铜溶液用量过多不利于更快收集氢气 |
| B.a ,c两点对应的氢气生成速率相等 |
| C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1 |
| D.d点没有构成原电池,反应速率减慢 |
D
试题分析:A、根据图像可知随着饱和硫酸铜的增加,收集相同体积的气体所需时间先逐渐减少,然后又逐渐增加,因此饱和硫酸铜溶液用量过多不利于更快收集氢气,A正确;B、根据图像可知a ,c两点对应的时间都是250s,所以氢气生成速率相等,B正确;C、b点对应的时间是150s,生成氢气的物质的量是0.336L÷22.4L/mol=0.015mol,消耗稀硫酸的物质的量是0.015mol,其浓度是0.015mol÷0.1L=0.15mol/L,所以反应速率为v( H2SO4)=0.15mol/L÷150s=1.0x10-3mol·L -1 ·s-1,C正确;D、d点锌也与硫酸铜溶液反应生成铜从而构成原电池,D不正确,答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( ) AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: 4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表: 3C+4D反应中,表示该反应速率最快的是( )。
3C+4D反应中,表示该反应速率最快的是( )。 2NH3(g)
2NH3(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
 CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。