题目内容
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
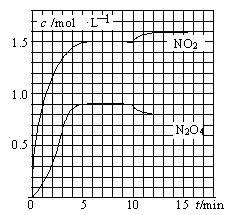
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

①2NO(g)+O2 (g)
 2NO2(g)
2NO2(g)②2NO2(g)
 N2O4(g)
N2O4(g)测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
| A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1 |
| B.T1℃时反应②的化学平衡常数K=0.6 |
| C.反应①、②均为吸热反应 |
| D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
AD
试题分析:A、前5min反应的平均速率v(N2O4)=0.9÷5=0.18mol·(L·min)-1,正确;B、T1℃时反应②的化学平衡常数K=0.9÷1.52=0.4,错误;C、若反应①、②均为吸热反应则升高温度平衡正向移动,N2O4浓度应增多,错误;D、此时反应与原反应等效平衡,平衡时N2O4的物质的量为0.9×2=1.8mol,即此反应N2O4需转化2-0.8=0.2mol转化率为10%,正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按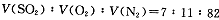 投料,在
投料,在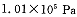 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。

 CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是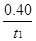 mol·L-1·min-1
mol·L-1·min-1 CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1): 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
 Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
 cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。 3C+4D反应中,表示该反应速率最快的是( )。
3C+4D反应中,表示该反应速率最快的是( )。