题目内容
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
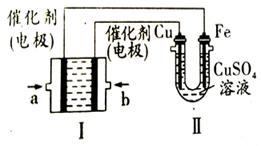
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。

(1)-77.6 (2分)
(2)① a d (1分) ② < (1分) > (1分) 66.7 (2分)
(3)NH4++H2O NH3·H2O+H+ (1分) a/200b (2分)
NH3·H2O+H+ (1分) a/200b (2分)
(4)变小(1分) CH4-8e-+10OH-= CO32-+7H2O (2分);2.24 (2分)
(2)① a d (1分) ② < (1分) > (1分) 66.7 (2分)
(3)NH4++H2O
 NH3·H2O+H+ (1分) a/200b (2分)
NH3·H2O+H+ (1分) a/200b (2分)(4)变小(1分) CH4-8e-+10OH-= CO32-+7H2O (2分);2.24 (2分)
试题分析:(1)①O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
②PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
③O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
①+②-③得到反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="-77.6" kJ·mol-1。
(2)①该反应是一个反应前后气体体积改变的化学反应,当反应混合物中各组成成分的百分含量保持不变时,反应容器中气体的压强也不再发生变化,故a 正确。
该反应是一个反应前后气体的质量不变的化学反应,体积不变的密闭容器意味容器的体积不变,导致混合气体的密度是一个恒量,不能说明该反应达到平衡状态,故b错误。
N2和H2的体积比为1:3,不能说明该反应达到平衡状态,故c错误。
化学方程式的前后计量数大小不同,混合气体的平均相对分子质量不变说明混合物中各组成成分的百分含量不变,能说明到达平衡状态,故d正确;
② 温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
化学平衡常数只与温度有关,合成氨反应是放热反应,A→B温度升高,平衡逆向移动,则化学平衡常数K变小,故答案为:>;
250℃、1.0×104kPa下,氨气的体积分数为50%,则
N2+3H2=2NH3
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
所以
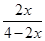 =50%,解得x=
=50%,解得x=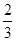 ,则氢气的转化率为
,则氢气的转化率为 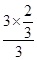 ×100%=66.7%,故答案为:66.7;
×100%=66.7%,故答案为:66.7;(3)根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,NH4NO3为强酸弱碱盐,水解呈酸性,NH4++H2O
 NH3·H2O+H+ ;根据一水合氨电离平衡得到:NH3·H2O
NH3·H2O+H+ ;根据一水合氨电离平衡得到:NH3·H2O NH4++OH-,平衡常数K=
NH4++OH-,平衡常数K=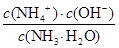 =
=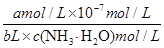 =2×10-5 mol·L-1,计算得到c(NH3·H2O)=
=2×10-5 mol·L-1,计算得到c(NH3·H2O)=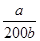 mol·L-1;
mol·L-1;(4)实现铁上镀铜,Cu为阳极,则b为正极,通入的气体O2,a为负极,甲烷失去电子,生成的CO2会和氢氧化钠反应,所以装置Ⅰ中溶液的pH变小,a极电极反应方程式为电极反应为CH4-8e-+10OH-=CO32-+7H2O;阴极电极反应为Cu2++2e-=Cu,质量增加25.6g为铜物质的量为0.4mol,转移电子为0.8mol,理论上消耗甲烷物质的量为:0.1mol,标准状况下的体积=0.1mol×22.4L·mol-1=2.24L。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1): cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
 4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表: 3C+4D反应中,表示该反应速率最快的是( )。
3C+4D反应中,表示该反应速率最快的是( )。 xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
 Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )