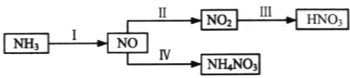
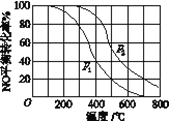
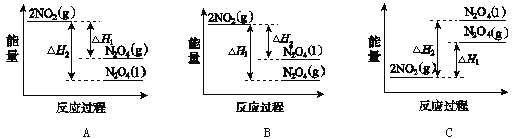
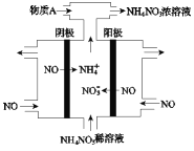
题目内容
【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
【答案】可观察到有白色沉淀产生 Ca2+ +SO42- =CaSO4↓ 没有现象产生 因为Ca2+ 已与SO42-反应,溶液中不再存在Ca2+ 有白色沉淀产生 因为生成的CaSO4 是微溶物,仍可电离出Ca2+ 产生白色沉淀 Ca2+ +CO32- =CaCO3 CaSO4沉淀在溶液中存在溶解平衡: CaSO4(s)![]() Ca2+ (aq)+SO42- (aq),由于上层清液中仍有少量出的 Ca2+,故可与CO32-反应生成更难溶的沉淀,说明CaCl2溶液和Na2SO4溶液反应存在限度
Ca2+ (aq)+SO42- (aq),由于上层清液中仍有少量出的 Ca2+,故可与CO32-反应生成更难溶的沉淀,说明CaCl2溶液和Na2SO4溶液反应存在限度
【解析】
CaSO4在水中微溶,CaCl2溶液中滴入Na2SO4溶液生成沉淀CaSO4,反应后的溶液中存在难溶电解质的溶解平衡:CaSO4(s)![]() Ca2+ (aq)+SO42- (aq),加入Na2CO3溶液会生成沉淀CaCO3,从可逆反应的特征和反应的限度解答本题。
Ca2+ (aq)+SO42- (aq),加入Na2CO3溶液会生成沉淀CaCO3,从可逆反应的特征和反应的限度解答本题。
(1)CaSO4在水中微溶,CaCl2溶液中滴入Na2SO4溶液生成沉淀CaSO4,可观察到有白色沉淀产生,反应的离子方程式为Ca2++SO42-=CaSO4↓;
(2)向上述反应后的清液中滴入适量1mol·L-1的Na2CO3溶液,如反应没有限度,Ca2+沉淀完全,则无现象,如反应存在限度,溶液中尚有较多Ca2+,则应生成白色沉淀CaCO3,提出实验假设:假设:①没有现象产生; ②有白色沉淀产生。理由:①因为Ca2+ 已与SO42-反应,溶液中不再存在Ca2+② 因为生成的CaSO4 是微溶物,仍可电离出Ca2+。
(3)CaCO3在水中难溶,反应后的清液中滴入适量1mol·L-1的Na2CO3溶液生成白色沉淀CaCO3,反应的离子方程式为Ca2++CO32-=CaCO3↓;
(4)解释:CaSO4沉淀在溶液中存在如下可逆反应: CaSO4(s)![]() Ca2+ (aq)+SO42- (aq)由于上层清液中仍有少量出的 Ca2+,故可与CO32-反应生成更难溶的沉淀。说明CaCl2溶液和Na2SO4溶液反应存在限度。
Ca2+ (aq)+SO42- (aq)由于上层清液中仍有少量出的 Ca2+,故可与CO32-反应生成更难溶的沉淀。说明CaCl2溶液和Na2SO4溶液反应存在限度。
故答案为:
实验步骤 | 向3——4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液 |
实验现象 | 可观察到有白色沉淀产生 |
离子方程式 | Ca2+ +SO42- =CaSO4↓ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①没有现象产生; ②有白色沉淀产生。 理由:①因为Ca2+ 已与SO42-反应,溶液中不再存在Ca2+② 因为生成的CaSO4 是微溶物,仍可电离出Ca2+。 |
实验证明你的假设 | 现象:产生白色沉淀 |
离子方程式 | Ca2+ +CO32- =CaCO3 |
解释 | CaSO4沉淀在溶液中存在如下可逆反应: CaSO4(s) |

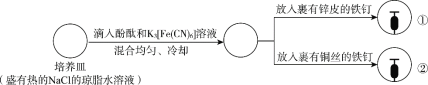
【题目】下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红; ②中…… |
A.NaCl的琼脂水溶液为离子迁移的通路
B.①中变红是因为发生反应2H++2e-=H2↑,促进了水的电离
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M—2e-=M2+(M代表锌或铁)