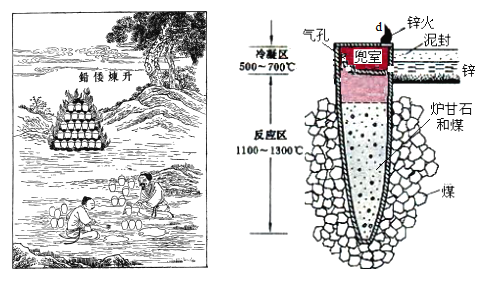
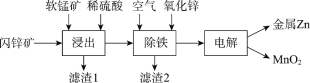
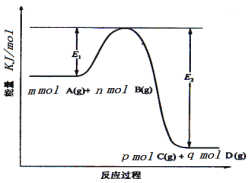
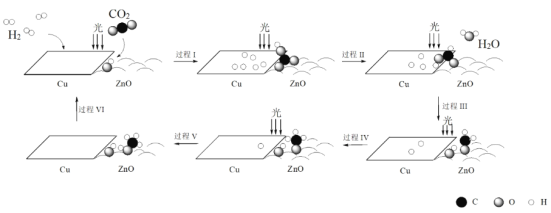
题目内容
【题目】在一定条件下,有下列物质:①8gCH4、②6.02×1023个HCl分子、③2mol O2。按由小到大的顺序填写下列空白(填写序号):
(1)摩尔质量____________________。
(2)物质的量____________________。
(3)分子数目____________________。
(4)原子数目____________________。
(5)质量____________________。
【答案】①<③<② ①<②<③ ①<②<③ ②<①<③ ①<②<③
【解析】
(1)摩尔质量以g/mol为单位,数值上等于物质的相对分子质量;
(2)根据n=![]() 计算甲烷的物质的量,根据n=
计算甲烷的物质的量,根据n=![]() 计算HCl的物质的量;
计算HCl的物质的量;
(3)由N=n·NA可知,物质的物质的量越大,含有分子数目越多;
(4)结合分子含有的原子数目计算原子物质的量,据此判断;
(5)根据m=n·M计算HCl、氧气的质量,据此判断。
(1)①CH4的摩尔质量为16g/mol,②HCl的摩尔质量为36.5g/mol,③O2的摩尔质量为32g/mol,故三种气体的摩尔质量由小到大的顺序为:①<③<②;
(2)①8gCH4的物质的量n=![]() =0.5mol;②6.02×1023个HCl分子的物质的量n=
=0.5mol;②6.02×1023个HCl分子的物质的量n=![]() =1mol,③2molO2,故三种气体的物质的量由小到大的顺序为:①<②<③;
=1mol,③2molO2,故三种气体的物质的量由小到大的顺序为:①<②<③;
(3)由N=n·NA可知,物质的物质的量越大,含有分子数目越多,结合(2)计算可知含有分子数目由小到大的顺序为:①<②<③;
(4)①8gCH4含有原子物质的量=0.5mol×5=2.5mol,②6.02×1023个HCl分子含有原子物质的量=1mol×2=2mol,③2molO2含有原子物质的量=2mol×2=4mol,故三种气体分子中含有原子数目由小到大的顺序为:②<①<③;
(5)①8gCH4,②6.02×1023个HCl分子的质量m(HCl)=1mol×36.5g/mol=36.5g,③2molO2的质量=2mol×32g/mol=64g,故三种气体分子质量由小到大的顺序为:①<②<③。

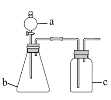
【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D
【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)