题目内容
【题目】已知X(g)+3Y(g)![]() 2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
A.充分反应后,放出热量为akJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1∶2
C.当体系的压强不再改变时,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
【答案】C
【解析】
A、该反应为可逆反应,不会完全进行,投入原料1mol并未完全反应,故放出的热量小于akJ,选项A不正确;
B、X和W分别为反应物和生成物,化学计量数只表示反应过程的转化比例,并不能说明达到平衡后的浓度之比,选项B不正确;
C、反应为气体体积减小的反应,随着反应的进行气体的物质的量变化则压强变化,当体系的压强不再改变时,表明该反应已达平衡,选项C正确;
D、若增大反应物浓度,正逆反应速率均会增加,选项D不正确。
答案选C。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
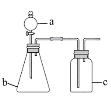
同步拓展阅读系列答案【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D
【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |