题目内容
【题目】青铜是人类历史上一项重大发明,它是铜(Cu)、锡(Sn) 和铅(Pb) 的合金,也是金属冶铸史上最早的合金 。 请回答 :
(1)基态Cu原子通过失去_____轨道电子转化为Cu+;Sn的原子序数为50,基态Sn原子的价层电子排布式为______。
(2)红氨酸(![]() ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。
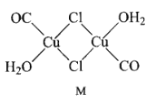
①与CO互为等电子体的离子为 _________(任写一种即可)。
②M中所有元素的电负性由大到小的顺序为 ____________。
③画图表示出M 中Cu原子形成的所有配位键_________。
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为___________。
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4 围成一个正四面体空隙 ,a2、a3、a4 、a5、a6、a7 围成一个正八面体空隙。
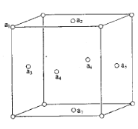
①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=____。
②若a2 与a3 的核间距离为d pm, 阿伏加德罗常数的值为NA,则铜晶体的密度为___gcm-3( 列出计算表达式)。
【答案】4s 5s25p2 3 sp3 轴对称 CN- 或 ![]() O> Cl> C> H> Cu
O> Cl> C> H> Cu 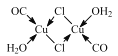 铜原子的半径小、价电子数多, 晶体中金属键强, 熔点高 1: 2: 1
铜原子的半径小、价电子数多, 晶体中金属键强, 熔点高 1: 2: 1 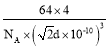
【解析】
(1)Cu原子核外电子排布式为1s22s22p63s23p63d104s1,基态Cu原子通过失去4s轨道电子转化为Cu+;Sn的原子序数为50,位于ⅣA族,基态Sn原子的价层电子排布式为5s25p2。故答案为:4s;5s25p2;
(2)红氨酸(![]() ) 分子中C 原子的价层电子对数目为
) 分子中C 原子的价层电子对数目为![]() =3;N原子的价层电子对数目为
=3;N原子的价层电子对数目为![]() =4, N原子的杂化方式为sp3;N原子的2p与 H原子的1s轨道形成杂化轨道, N原子与 H原子形成共价键的电子云对称形式为轴对称。故答案为:3;sp3;轴对称;2
=4, N原子的杂化方式为sp3;N原子的2p与 H原子的1s轨道形成杂化轨道, N原子与 H原子形成共价键的电子云对称形式为轴对称。故答案为:3;sp3;轴对称;2
(3)①由电子-电荷互换法可得:与CO互为等电子体的离子为CN-或 ![]() (任写一种即可)。故答案为:CN-或
(任写一种即可)。故答案为:CN-或 ![]() ;
;
②同周期从左到右元素的电负性变大,同主族从上到下电负性变小,结合电负性的值:O-3.5,Cl-3.0,C-2.5,H-2.1,Cu-1.9,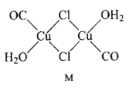 M中所有元素的电负性由大到小的顺序为 O> Cl> C> H> Cu。故答案为:O> Cl> C> H> Cu;
M中所有元素的电负性由大到小的顺序为 O> Cl> C> H> Cu。故答案为:O> Cl> C> H> Cu;
③铜提供空轨道,配位体的配原子C、Cl、O提供孤电子对,M 中Cu原子形成的所有配位键如图 。故答案为:
。故答案为: ;
;
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,其原因为铜原子的半径小、价电子数多, 晶体中金属键强, 熔点高。故答案为:铜原子的半径小、价电子数多, 晶体中金属键强, 熔点高;
(5)①晶体铜的晶胞属于面心立方最密堆积,每个晶胞中平均占有4个铜原子;晶胞的每一个顶点与邻近的3个面心可以构成一个正四面体,共形成8个正四面体空隙;6个面心构成一个正八面体,每一条棱的中心都处于正八面体的中心,共有12条棱,属于该晶胞的正八面体的空隙共有1+12![]() =4。综上所述,铜原子数、正四面体空隙数和正八面体空隙数之比为4:8:4=1:2:1;故答案为:1: 2: 1;
=4。综上所述,铜原子数、正四面体空隙数和正八面体空隙数之比为4:8:4=1:2:1;故答案为:1: 2: 1;
②若a2 与a3 的核间距离为d pm,晶胞边长为![]() dpm,晶胞中铜原子个数为:8×
dpm,晶胞中铜原子个数为:8×![]() +6×
+6×![]() =4,阿伏加德罗常数的值为NA,则铜晶体的密度为
=4,阿伏加德罗常数的值为NA,则铜晶体的密度为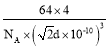 gcm-3(列出计算表达式)。故答案为:
gcm-3(列出计算表达式)。故答案为: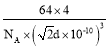 。
。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 向5mL 0.005mol·L-1 FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1 mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
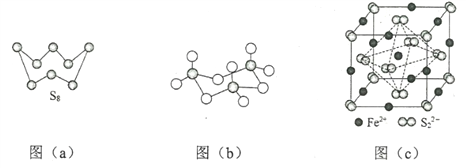
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
