题目内容
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
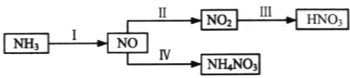
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______。
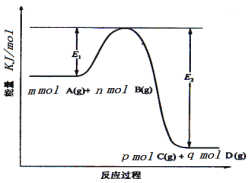
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
①比较p1、p2的大小关系:_______。
②随温度升高,该反应平衡常数变化的趋势是______。
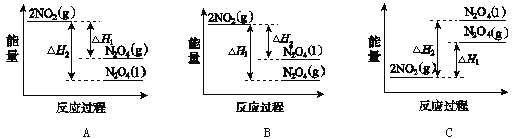
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
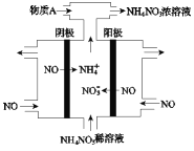
①写出阳极的电极反应式______
②为使电解产物全部转化为NH4NO3,需补充A。A是_____,说明理由:____。
【答案】4NH3+5O2![]() 4NO+6H2O p1<p2 减小 A NO-3e+2H2O=NO3-+4H+ NH3 根据反应:8NO+7H2O
4NO+6H2O p1<p2 减小 A NO-3e+2H2O=NO3-+4H+ NH3 根据反应:8NO+7H2O![]() 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
【解析】
(1)在催化剂、加热条件下,氨气被氧化生成NO和水,反应方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,升高温度平衡向逆反应方向移动,则化学平衡常数减小;
(3)降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合。
答案选A;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。
①写出阳极的电极反应式为NO-3e-+2H2O=NO3-+4H+;
②根据反应:8NO+7H2O![]() 3NH4NO3+2HNO3,电解产生的HNO3多,为使电解产物全部转化为NH4NO3,需补充A。A是NH3。
3NH4NO3+2HNO3,电解产生的HNO3多,为使电解产物全部转化为NH4NO3,需补充A。A是NH3。

【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)