题目内容
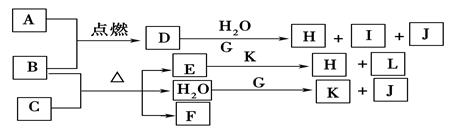
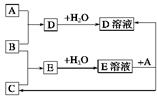
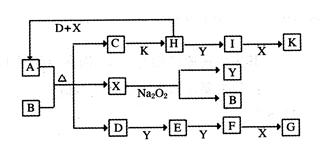
(12分)下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
回答下列问题:
(1)K所含的化学键有 。
(2)D的水溶液与G反应的总离子方程式为_______________________________________________。
(3)写出工业上制取单质G的化学方程式 。
(4)将气体F通入下列装置中
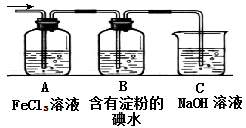
写出A、B中的离子方程式:
、 。
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为
。

回答下列问题:
(1)K所含的化学键有 。
(2)D的水溶液与G反应的总离子方程式为_______________________________________________。
(3)写出工业上制取单质G的化学方程式 。
(4)将气体F通入下列装置中

写出A、B中的离子方程式:
、 。
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为
。
(1)离子键、共价键(2)6Na+2Fe3++6H2O===2Fe(OH)3↓+6Na++3H2↑(3)2NaCl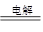 2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
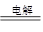 2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)试题分析:该题的突破口为B在A中燃烧为棕色的烟,可能为Fe在氯气中燃烧现象;I焰色为黄色,为钠的化合物;J中只有质子为H;F是品红褪色为SO2;结合框图综合考虑可以确定:A为Cl2,B为Fe,C为H2SO4,D为FeCl3,E为Fe2(SO4)3、F为SO2,G为Na,H为Fe(OH)3,I为NaCl,J为H2,K为NaOH,L为Na2SO4;
(1)氢氧化钠含离子键和极性共价键。
(2)钠与氯化铁溶液反应可认为钠先与水反应,生成的氢氧化钠再与氯化铁溶液反应,离子方程式为6Na+2Fe3++6H2O===2Fe(OH)3↓+6Na++3H2↑。
(3)工业上电解熔融氯化钠制钠,方程式为2NaCl
 2Na+Cl2↑。
2Na+Cl2↑。(4)二氧化硫通入氯化铁、碘水中发生氧化还原反应,离子方程式分别为SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-。
(5)二氧化硫通入氢氧化钠溶液中所得溶质成分可能有四种:亚硫酸钠和氢氧化钠、亚硫酸钠、亚硫酸钠和亚硫酸氢钠、亚硫酸氢钠,无论哪种情况均有电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)。
点评:充分挖掘题眼,利用特征现象、特征反应确定物质。

练习册系列答案
相关题目
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。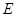 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.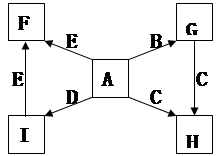
 (1)A、F的化学式分别为 、 。?
(1)A、F的化学式分别为 、 。?